
����Ŀ��þ����Ͻ���һ����;�ܹ�Ľ������ϣ�Ŀǰ������60%��þ�ǴӺ�ˮ����ȡ�ġ���Ҫ�������£�

(1)Ϊ��ʹMgSO4ת��ΪMg(OH)2���Լ�������ѡ��________��ҪʹMgSO4��ȫת��Ϊ�����������Լ�����ӦΪ________________��
(2)�����Լ������ܹ�����õ�Mg(OH)2�����ķ�����_____________��
(3)�Լ���ѡ��________��д���䷴Ӧ�����ӷ���ʽ_______��
(4)��ˮMgCl2������״̬�£�ͨ������þ���������÷�Ӧ�Ļ�ѧ����ʽΪ________��
���𰸡�(1)ʯ���� ���� (2)���� (3)���� Mg(OH)2��2H��=Mg2����2H2O (4)MgCl2(����)![]() Mg��Cl2��
Mg��Cl2��
��������
(1)��ҵ�ϳ��������۵�ʯ����ʹ��ˮ�е�MgSO4ת��ΪMg(OH)2��ΪʹMgSO4��ȫת��ΪMg(OH)2��Ӧ�������ʯ���顣
(2)����ʯ�������Mg(OH)2��ͨ�����˽�Mg(OH)2���������
(3)�������ܽ�Mg(OH)2����Ӧ�����ӷ���ʽΪMg(OH)2��2H��=Mg2����2H2O
(4)��ҵ�ϵ������MgCl2��ȡMg����Ӧ�Ļ�ѧ����ʽΪMgCl2(����)![]() Mg��Cl2��
Mg��Cl2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ����ʵ��Ҫ����50 mL 0.50 mol��L��1��������50 mL 0.55 mol��L��1��NaOH ��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų������������к��ȡ�����˵������ȷ����

A. ʵ�������û��������ʧ
B. ͼ��ʵ��װ��ȱ�ٻ��β��������
C. �ձ���������ֽ���������ǹ̶�С�ձ�
D. ���ձ��ϲ���Ӳֽ�壬��õĦ�H��ƫС
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ�ÿ��Խ���������CO2ת��Ϊȼ������CO������˵������ȷ����
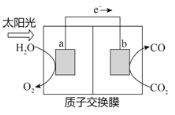
A. �缫a���淢����ԭ��Ӧ
B. ��װ�ù���ʱ��H+��b������a�����ƶ�
C. ��װ����ÿ����2 mol CO��ͬʱ����1 mol O2
D. ��Ӧ�����У��缫a������Һ��pHֵ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ǵ��Ӳ��ϵ����㣬�����й���Ĵ��ԣ�����Һ��������ԣ��������з�ɢ������ֱ����5.5 nm��36 nm֮�䡣����˵����ȷ���� ( )
A. ������������Һ B. ������ܲ��ȶ�
C. �������ܲ��������ЧӦ D. �������з�ɢ�����Ӳ���ͨ����ֽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵��������ǣ� ��
A.����ԽС����ʾ��ѧ��Խ�ι̣�Խ���Զ���
B.�ɼ�����ԭ�Ӻ�Խ��������Խ�̣���ѧ��Խ�ι̣�����Խ�ȶ�
C.�ƻ���ѧ��ʱ�������������γɻ�ѧ��ʱ�ͷ�����
D.���ܡ�����ֻ�ܶ��Եط�����ѧ����ǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ѧ��ѧ�г�������֮���һЩ��Ӧ��ϵ�����в��ֲ���δд����������X�ǹ��壬B��G��Һ�壬�����Ϊ���塣������ͼ��ϵ�ƶϣ�

(1)д����ѧʽ��X_______��A________��B_______��
(2)ʵ�����ռ�����D��F�ķ���������_______����________����
(3)д��C��E�Ļ�ѧ����ʽ��____________��
(4)��д��A��E��Ӧ����D�Ļ�ѧ����ʽ��_______________
(5)��������A�ķ�����������________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�������Ա�������CO2��CH4ת��Ϊ�߸���ֵ��ƷCH3COOH�Ĵ���Ӧ���̡�������ʾ��ͼ���¡�

����˵������ȷ���ǣ� ��
A. ����CH3COOH�ܷ�Ӧ��ԭ��������Ϊ100%
B. CH4��CH3COOH��������C�DH����������
C. �������������������C�DC��
D. �ô���ѡ���Ի�˼������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҵ���������Ũ���������£�ͨ��������Ӧ�Ƶ�������������Ӧ�¶�Ϊ115��125�棬��Ӧװ����ͼ�����жԸ�ʵ��������������

A. ������ˮԡ����
B. ����������������������
C. �ᴿ����������Ҫ����ˮ������������Һϴ��
D. ������������������Ҵ���ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������õİ뵼����ϣ��ྦྷ����Ҫ����SiHCl3��ԭ����������
(1)��ԭ�Ӻ�����_____��������ͬ�ĵ��ӡ������ӵĺ�������Ų�ʽΪ________________________������������Ԫ���У���Ԫ�ؼ���������Ԫ�ص�ԭ�Ӱ뾶�Ӵ�С��˳����________��
(2)��ԭ�ӽṹ�ǶȽ���Ԫ������Ԫ�صķǽ�����ǿ��________________________��
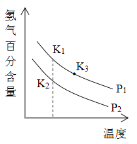
(3)900�����Ϸ���SiHCl3(g)+H2(g)![]() Si(s)+3HCl(g)��Ӧ��ƽ��ʱH2�İٷֺ������¶ȡ�ѹǿ(P)�仯��ͼ(KΪ��ͬ����ʱ��ƽ�ⳣ��)���ӻ�ѧ��Ӧ���ʽǶ���˵��������Ӧ�Ѵﵽƽ��״̬_______��
Si(s)+3HCl(g)��Ӧ��ƽ��ʱH2�İٷֺ������¶ȡ�ѹǿ(P)�仯��ͼ(KΪ��ͬ����ʱ��ƽ�ⳣ��)���ӻ�ѧ��Ӧ���ʽǶ���˵��������Ӧ�Ѵﵽƽ��״̬_______��
(4)����Ӧ�������ݻ�Ϊ2L��10min��ﵽƽ�⣬��ù��������������2.8g����HCl��ƽ����Ӧ����Ϊ______________��
(5)P1____P2(ѡ����>������<������=��)��K1��K2��K3��С��ϵʽΪ___________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com