
【题目】晶体硅是良好的半导体材料,多晶硅主要采用SiHCl3还原工艺生产。
(1)硅原子核外有_____种能量不同的电子。氯离子的核外电子排布式为________________________。短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是________。
(2)从原子结构角度解释硅元素与氯元素的非金属性强弱________________________。
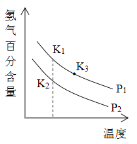
(3)900℃以上发生SiHCl3(g)+H2(g)![]() Si(s)+3HCl(g)反应,平衡时H2的百分含量随温度、压强(P)变化如图(K为不同条件时得平衡常数)。从化学反应速率角度来说明上述反应已达到平衡状态_______。
Si(s)+3HCl(g)反应,平衡时H2的百分含量随温度、压强(P)变化如图(K为不同条件时得平衡常数)。从化学反应速率角度来说明上述反应已达到平衡状态_______。
(4)若反应容器的容积为2L,10min后达到平衡,测得固体的质量增加了2.8g,则HCl的平均反应速率为______________。
(5)P1____P2(选填“>”、“<”或“=”);K1、K2、K3大小关系式为___________。
【答案】5 1s22s22p63s23p6 S>Cl>F 氯和硅两元素同周期,电子层数相同,质子数氯>硅,原子半径氯<硅,因此原子核对最外层电子的吸引能力氯>硅,得电子能力氯>硅 氢气的生成速率等于氢气的消耗速率(合理即给分) 0.015mol/(Lmin) > K1=K2<K3
【解析】
(1)根据硅原子核外电子排布为1s22s22p63s23p2,确定核外有多少种能量不同的电子。根据氯原子得1个电子变为氯离子,写出氯离子核外电子排布式;根据同一主族,从上到下,原子半径增大,同一周期,从左到右,原子半径减小规律比较S、Cl、F半径大小;
(2) 同周期元素,从左到右,质子数越大,原子半径越小,原子核对最外层电子的吸引能力越强进行分析;
(3)化学平衡状态的特征是υ(正)=υ(逆)、各组分的浓度保持不变,据此进行分反应已达到平衡状态时,氢气的生成速率与氢气的消耗速率关系;
(4) 先计算出硅的变化量,据此求出n(HCl),根据υ(HCl)=c/t进行计算;
(5) 当温度不变时,压强由P2变为P1,氢气的百分含量增大,说明平衡左移,据此分析P1与P2的关系;平衡常数只是温度的函数,据此进行分析。
(1) 硅原子核电荷数为14,核外电子排布为1s22s22p63s23p2,据此可知硅原子核外有5种能量不同的电子;氯原子核电荷数为17,核外电子排布为1s22s22p63s23p5,氯原子得一个电子变为氯离子,氯离子的核外电子排布式为1s22s22p63s23p6;短周期主族元素中,氯元素及与其相邻元素的原子分别为硫和氟,同一主族,从上到下,原子半径增大,同一周期,从左到右,原子半径减小,半径从大到小的顺序是S>Cl>F;
综上所述,本题答案是:5,1s22s22p63s23p6,S>Cl>F。
(2) 氯和硅两元素同周期,电子层数相同,质子数氯>硅,原子半径氯<硅,因此原子核对最外层电子的吸引能力氯>硅,得电子能力氯>硅,所以氯元素的非金属性强于硅元素;
综上所述,本题答案是:氯和硅两元素同周期,电子层数相同,质子数氯>硅,原子半径氯<硅,因此原子核对最外层电子的吸引能力氯>硅,得电子能力氯>硅。
(3)化学平衡状态的特征是υ(正)=υ(逆) 、各组分的浓度保持不变,所以上述反应已达到平衡状态时,氢气的生成速率等于氢气的消耗速率;
综上所述,本题答案是:氢气的生成速率等于氢气的消耗速率(合理即给分)。
(4) 根据SiHCl3(g)+H2(g)![]() Si(s)+3HCl(g)可知,10min后达到平衡,测得固体硅的质量增加了2.8g,即0.1mol,生成n(HCl)=0.3mol,所以HCl的平均反应速率为0.3mol/(2L×10min)= 0.015mol/(Lmin);
Si(s)+3HCl(g)可知,10min后达到平衡,测得固体硅的质量增加了2.8g,即0.1mol,生成n(HCl)=0.3mol,所以HCl的平均反应速率为0.3mol/(2L×10min)= 0.015mol/(Lmin);
综上所述,本题答案是:0.015mol/(Lmin)。
(5)当温度不变时,压强由P2变为P1,氢气的百分含量增大,说明平衡左移,增大压强平衡逆向移动,所以P1>P2;平衡常数只是温度的函数,因为K1、K2所处温度相同,所以K1=K2;温度升高,氢气的百分含量减小,平衡右移,正反应为吸热反应,所以K3>K1=K2;
综上所述,本题答案是:>;K1=K2<K3。


科目:高中化学 来源: 题型:
【题目】镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:

(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用________,要使MgSO4完全转化为沉淀,加入试剂的量应为________________。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是_____________。
(3)试剂②选用________;写出其反应的离子方程式_______。
(4)无水MgCl2在熔融状态下,通电后产生镁和氯气,该反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海带中提取碘的实验过程中,涉及到下列操作,其中正确的是
A. 将海带灼烧成灰
B. 过滤得含I-溶液
C. 萃取后下面放出碘的苯溶液
D. 分离碘并回收苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同的状况下有A、B两种气体,若VA=VB,质量mA<mB,则( )
A. MA = MB B. MA < MB C. nA > nB D. nA < nB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在密闭容器内进行着某一反应,X 气体、Y 气体的物质的量随反应时间变化的曲线如右图。下列叙述中正确的是

A. 反应的化学方程式为5Y![]() X B. t1 时,Y 的浓度是 X 浓度的1.5 倍
X B. t1 时,Y 的浓度是 X 浓度的1.5 倍
C. t2 时,正、逆反应速率相等 D. t3 时,逆反应速率大于正反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.反应的热化学方程式的书写中,ΔH的大小与化学计量数无关
B.ΔH <0、ΔS <0的反应在高温时能自发进行
C.实验室欲快速制取氢气,可利用粗锌与稀硫酸反应
D.金属表面镀银时,应把镀件作为电镀池的阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二钒广泛用于冶金、化工等行业,主要用于冶炼钒铁、用作冶金添加剂,占五氧化二钒总消耗量的80%以上,其次是用作有机化工的催化剂。为了增加V2O5的利用率我们从废钒催化剂(主要成分V2O5、VOSO4、K2SO4、SiO2和Fe2O3等)中回收V2O5的一种生产工艺流程示意图如下:
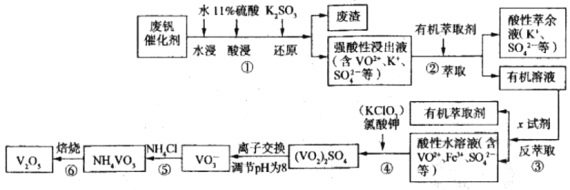
(1)①中废渣的主要成分是__________________________;
①中V2O5发生反应的离子方程式为________________________________________。
(2)②、③中的变化过程可简化为(下式中的R表示VO2+或Fe3+,HA表示有机萃取剂的主要成分):R2(SO4) (水层)+2nHA(有机层) ![]() 2RAn(有机层)+nH2SO4(水层)。
2RAn(有机层)+nH2SO4(水层)。
②中萃取时必须加入适量碱,其原因是________________________________________;
实验室进行萃取操作使用的玻璃仪器为________________________________________。
(3)实验室用的原料中V2O5占6%(原料中的所有钒已换算成V2O5)。取100g该废钒催化剂按工业生产的步骤进行实验当加入100ml0.1mol/L的KClO3溶液时,溶液中的钒恰好被完全处理,假设以后各步钒没有损失,则该实验中钒的回收率是________________[M(V2O5)=182g/mol]
(4)25℃时取样进行试验分析,得到钒沉淀率和溶液pH之间的关系如下表:

试判断在实际生产时,⑤中加入氨水调节溶液的最佳pH为_________;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则此时溶液中c(Fe2+)≤__________。已知:25℃时Ksp[Fe(OH)3]=2.6×10-39
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应H2(g) + I2(g)![]() 2HI(g),在恒温时由H2(g)和I2(g)开始反应,下列说法正确的是
2HI(g),在恒温时由H2(g)和I2(g)开始反应,下列说法正确的是
A. H2(g)的消耗速率与HI(g)的生成速率比为2:1
B. 增大压强(通过改变体积实现),混合气体的颜色不变
C. 正、逆反应速率的比值是恒定的
D. 达到平衡时,用同种物质表示的正、逆反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水脱氮工艺中有一种方法是在废水中加入NaClO使NH4+完全转化为N2,该反应可表示为2NH4++3ClO-=N2↑+3Cl-+2H++3H2O。下列说法中,不正确的是( )
A.反应中氮元素被氧化
B.还原性NH4+>Cl-
C.反应中氯元素被还原
D.经此法处理过的废水可以直接排放
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com