
 .
.分析 (1)①氮气分子中存在氮氮三键,氮原子最外层为8电子;NH3属于共价化合物,分子中存在3对共用电子对,氮原子最外层为8个电子;
②反应开始时,n(N2)=6mol,n(H2)=12mol,2min后达到平衡,此时n(H2)=3mol,以此可计算各物质的平衡浓度,进而计算反应速率以及平衡常数;
③化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量不发生变化,以此判断;
(2)①在催化剂条件下,氢气和硝酸根离子发生氧化还原反应生成氮气、水和氢氧根离子;
②亚硝酸根离子水解是吸热反应,根据外界条件对其水解反应影响来分析;
③在阴极反应是NO3-得电子发生还原反应生成N2.
解答 解:(1)①氮气分子中存在氮氮三键,氮原子最外层为8电子,氮气的结构式为N≡N;
NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子,故NH3的电子式为: ,
,
故答案为:N≡N; ;
;
②反应开始时,n(N2)=6mol,n(H2)=12mol,2min后达到平衡,此时n(H2)=3mol,则
N2(g)+3H2(g)?2NH3(g)
起始(mol) 6 12 0
转化(mol) 3 9 6
平衡(mol) 3 3 6
则V(NH3)=$\frac{\frac{6mol}{3L}}{2min}$=1mol/(L•min),
体积为3L,则平衡浓度分别为1mol.L、1mol/L、2mol/L,
K=$\frac{{2}^{2}}{1×{1}^{3}}$=4,
故答案为:1; 4;
③A.3v正(N2)=v正(H2),都是正反应速率,不能说明达到平衡状态,故A错误;
B.反应前后体积不等,则容器压强不再发生变化,可说明达到平衡状态,故B正确;
C.容器的体积以及气体的质量不变,无论是否达到平衡状态,容器内气体密度都不发生变化,故C错误;
D.N2的体积分数不再发生变化,可说明达到平衡状态,故D正确;
E.若单位时间内生成x molN2的同时,消耗x mol NH3,正逆反应速率不等,则反应没有达到平衡状态,故E错误,
故答案为:BD;
(2)①催化剂存在下,H2能将NO3-还原为N2,25℃时,反应10min,溶液的pH由7变为12,说明反应后溶液呈碱性,反应的离子方程式为5H2+2NO3-═N2+2OH-+4H2O,
故答案为:5H2+2NO3-═N2+2OH-+4H2O;
②亚硝酸盐水解是吸热反应,且水解时生成氢氧根离子,稀释亚硝酸盐溶液能促进其水解,所以要使NO2-水解使溶液中c(OH-)变大,可促进NO2-水解的措施有加热、加水或加酸等,
故答案为:升温、加水(稀释)、加酸等(任意两种即可);
③在阴极反应是NO3-得电子发生还原反应生成N2,阴极上发生的电极反应式为:2NO3-+10e-+6H2O=N2↑+12OH-,
故答案为:2NO3-+10e-+6H2O=N2↑+12OH-.
点评 本题考查较为综合,为高考常见题型和高频考点,侧重于学生的分析能力和计算能力的考查,题目涉及化学平衡的计算、平衡状态的判断,以及原电池、电解池知识,注意把握平衡状态的判断以及电解池的工作原理,难度中等.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Mn(OH)2 |
| 开始沉淀时的pH | 2.7 | 4.0 | 6.4 | 7.7 |
| 完全沉淀时的pH | 3.7 | 5.2 | 8.0 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
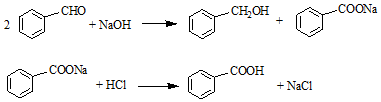
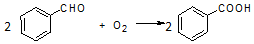
| 名称 | 分子量 | 性状 | 相对密度 (g•cm-3) | 沸点 (℃) | 溶解度 | ||
| 水 | 乙醚 | ||||||
| 苯甲醛 | 106 | 无色液体 | 1.04 | 179 | 微溶 | 易溶 | |
| 苯甲酸 | 122 | 无色晶体 | 1.27 | 249 | 0.21g | 66g | |
| 苯甲醇 | 108 | 无色液体 | 1.04 | 205 | 微溶 | 易溶 | |
| 乙醚 | 74 | 无色液体. | 0.71 | 35 | 不溶 | -- | |
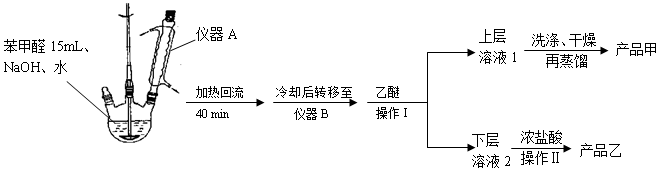
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
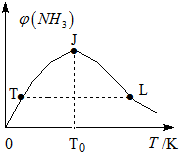 氢气是新型能源和重要化工原料.
氢气是新型能源和重要化工原料.| 容器编号 | 起始时各物质的物质的量/mol | 平衡时反应中的能量变化 | ||
| H2 | N2 | NH3 | ||
| Ⅰ | 3n | n | 0 | 放出热量a kJ |
| Ⅱ | 3n | 2n | 0 | 放出热量b kJ |
| Ⅲ | 6n | 2n | 0 | 放出热量c kJ |
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | … |
| NH3/mol | 2 | 1.0 | 0.5 | 0.25 | 0.24 | 0.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
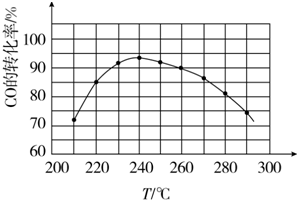
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/mol•L-1 | 0.64 | 0.50 | 0.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
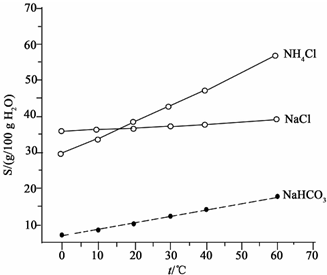
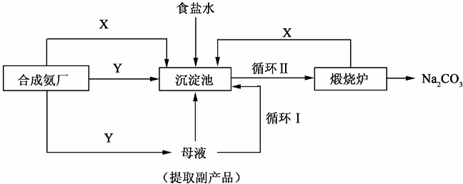
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯净水 | B. | 0.lmol/LHCl | C. | 1.0mol/LCH3COOH | D. | 0.5mol/LH2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C+H2O $\frac{\underline{\;高温\;}}{\;}$CO+H2 | B. | 3NO2+H2O=2HNO3+NO | ||
| C. | Cl2+SO2+H2O=H2SO4+2HCl | D. | 2F2+2H2O=4HF+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
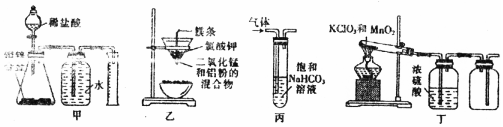
| A. | 装置甲:测定合金中Zn的含量 | B. | 装置乙:制取金属锰 | ||
| C. | 装置丙:洗气除去SO2中的CO2 | D. | 装置丁:实验室制取O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com