
分析 I.(1)根据难挥发性酸制备挥发性酸的原理,浓硫酸与氯化钠晶体反应生成HCl气体,硫酸钠和焦炭、石灰石反应的产物之一为CaS,说明发生了氧化还原反应,S元素的化合价降低,Na2SO4作氧化剂,则作还原剂的为焦炭,C元素的化合价升高为+4价,由此可判断产物还有碳酸钠和二氧化碳;
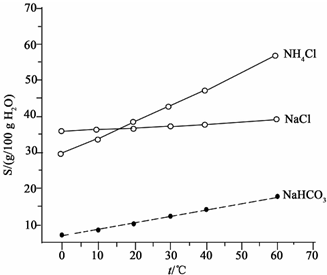
II.(2)由图2 可知碳酸氢钠的溶解度小于氯化钠、氯化铵,以食盐、氨气(来自炼焦副产品)和二氧化碳(来自石灰石)为原料,可生成碳酸氢钠;
(3)反应生成氯化铵,可与氢氧化钙反应生成氨气以循环使用;
III.(4)合成氨工厂需要向制碱厂提供两种原料气体,它们分别是二氧化碳和氨气;二氧化碳在水溶液中溶解度小,生成碳酸氢钠少,不能析出晶体,而氨气在水中的溶解度大,先通氨气后通二氧化碳产生碳酸氢铵多,有利于碳酸氢钠的析出;
(5)碳酸氢钠能溶于水,析出晶体后的溶液要循环利用,从母液中有NH4Cl可以做肥料;
(6)根据氮原子守恒可知,NH3~NO~HNO3,以此计算.
解答 解:I.(1)根据难挥发性酸制备挥发性酸的原理,浓硫酸与氯化钠晶体反应生成HCl气体,反应方程式为:2NaCl+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2HCl↑;硫酸钠和焦炭、石灰石反应的产物之一为CaS,说明发生了氧化还原反应,S元素的化合价降低,Na2SO4作氧化剂,则作还原剂的为焦炭,C元素的化合价升高为+4价,由此可判断产物还有碳酸钠和二氧化碳,其反应方程式为Na2SO4+2C+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaS+Na2CO3+CO2↑;
故答案为:2NaCl+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2HCl↑,Na2SO4+2C+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaS+Na2CO3+CO2↑;
II.(2)由图2 可知碳酸氢钠的溶解度小于氯化钠、氯化铵,以食盐、氨气(来自炼焦副产品)和二氧化碳(来自石灰石)为原料,可生成碳酸氢钠,反应的离子方程式为Na++NH3+H2O+CO2$\frac{\underline{\;\;△\;\;}}{\;}$NaHCO3↓+NH4+,故答案为:Na++NH3+H2O+CO2$\frac{\underline{\;\;△\;\;}}{\;}$NaHCO3↓+NH4+;
(3)反应生成氯化铵,可与氢氧化钙反应生成氨气以循环使用,反应的化学方程式为2NH4C1+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaC12+2NH3↑+2H2O,
故答案为:2NH4C1+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaC12+2NH3↑+2H2O;
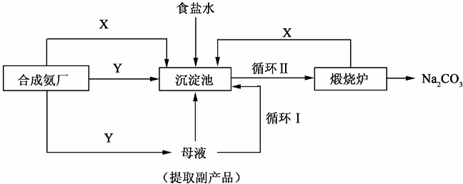
III.(4)合成氨工厂需要向制碱厂提供两种原料气体,它们分别是二氧化碳和氨气,X可由煅烧炉生成,X为二氧化碳,则Y为氨气;二氧化碳在水溶液中溶解度小,生成碳酸氢钠少,不能析出晶体,而氨气在水中的溶解度大,先通氨气后通二氧化碳产生碳酸氢铵多,有利于碳酸氢钠的析出;
故答案为:NH3;是;氨气在水中的溶解度大,先通氨气后通二氧化碳产生碳酸氢铵多,有利于碳酸氢钠的析出;
(5)碳酸氢钠能溶于水,析出晶体后的溶液中还含有较多碳酸氢钠,所以要循环利用,从母液中有NH4Cl可以做肥料,
故答案为:循环I;作化肥;
(6)由NH3制NO的产率是94%、NO制HNO3的产率是89%,根据氮原子守恒可知,NH3~NO~HNO3,则1mol氨气可得到硝酸1mol×94%×89%=0.8366mol,由HNO3+NH3═NH4NO3,则该反应消耗的氨气的物质的量为0.8366mol,氨气的质量之比等于物质的量之比,则制HNO3所用去的NH3的质量占总耗NH3质量的百分数为 $\frac{1mol}{1mol+0.8366mol}$×100%=54%;即制HNO3所用去的NH3的质量占总耗NH3质量的54%,
故答案为:54.
点评 本题考查了工业制备原理应用,流程分析,实验制备物质的分析判断,为高考常见题型和高频考点,注意把握利用物质的转化及质量守恒的方法来进行简单计算,使用硝酸铵的注意事项,明确转化中的化学反应得出物质之间的关系是解答的关键,题目难度中等.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.

 扑热息痛的结构简式为
扑热息痛的结构简式为


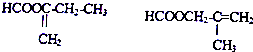
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
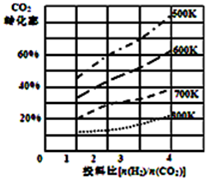 将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(l)
将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(l)| P1 | P2 | P3 | |
| I.2.0molCO2 6.0molH2 | 0.10mol | 0.04mol | 0.02mol |
| Ⅱ.1.0mol CO2 3.0molH2 | X1 | Y1 | Z1 |
| Ⅲ.1.0molCH3OCH3 3.0molH2O | X2 | Y3 | Z2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4溶液与NaOH溶液混合 | B. | HCl气体通入Ca(OH)2溶液中 | ||
| C. | HNO3溶液与KOH溶液混合 | D. | NH4HSO4溶液与NaOH溶液混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
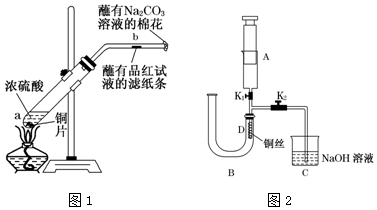
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Ca2+、HCO3-、Cl- | B. | Fe2+、Ca2+、Cl-、NO3- | ||
| C. | K+、Fe2+、SO42-、Br- | D. | Na+、K+、SO42-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
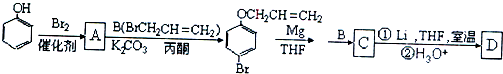
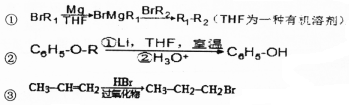
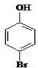 、
、 .
. 是化合物B的一种同分异构体,用1H核磁共振谱可以证明该化合物中有2种氢处于不同的化学环境.
是化合物B的一种同分异构体,用1H核磁共振谱可以证明该化合物中有2种氢处于不同的化学环境. 的有机反应类型取代反应.
的有机反应类型取代反应. .
.
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com