
 氢气是新型能源和重要化工原料.
氢气是新型能源和重要化工原料.| 容器编号 | 起始时各物质的物质的量/mol | 平衡时反应中的能量变化 | ||
| H2 | N2 | NH3 | ||
| Ⅰ | 3n | n | 0 | 放出热量a kJ |
| Ⅱ | 3n | 2n | 0 | 放出热量b kJ |
| Ⅲ | 6n | 2n | 0 | 放出热量c kJ |
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | … |
| NH3/mol | 2 | 1.0 | 0.5 | 0.25 | 0.24 | 0.24 |
分析 (1)已知:①2CO(g)+O2(g)=2CO2(g)△H1
②CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H2
由盖斯定律②-①-2×③可得CH4(g)+CO2(g)=2CO(g)+2H2(g);该方法减少了二氧化碳的排放;
(2)①恒温相同体积的容器,以Ⅰ为参照,Ⅱ则相当于在Ⅰ的平衡基础上加入n mol氮气,平衡较Ⅰ正向移动,Ⅲ的初始投入量是Ⅰ的两倍,则考虑为两个Ⅰ的平衡总和,容积相同,则将两个Ⅰ压缩体积,所以Ⅲ相当于对Ⅰ增大压强,平衡正向移动,据此分析;
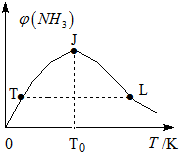
②TJ段未达到平衡,反应向生成氨方向进行,温度升高,反应加快,氨气体积分数增大;当J点达到平衡,JL段:该正反应是放热反应,升高温度,平衡向逆方向移动,促进氨分解,氨的体积分数减小.L点温度高于T点温度,两点的各物质浓度相等;
③根据v=$\frac{△c}{△t}$计算氨气表示的反应速率,再由反应速率之比等于化学计量数之比计算氢气表示的反应速率;
④稀溶液总体积等于两种溶液体积之和,根据电荷守恒计算离子的浓度,根据电离平衡常数表达式计算即可;
(3)氢气直接作燃料电池的负极上的反应是:H2-2e-+2OH-=2H2O,根据能量密度定义计算即可.
解答 解:(1)已知:①2CO(g)+O2(g)=2CO2(g)△H1
②CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H2
由盖斯定律②-①-2×③可得CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=△H2-△H1-2△H3;该方法减少二氧化碳排放,缓解温室效应;
故答案为:△H2-△H1-2△H3;减少二氧化碳排放,缓解温室效应;
(2)①A、实验I和III比较,实验III相当于实验I体积压缩一半,加压时平衡向正方向移动,N2转化率增大,III中氮气转化率大于I中氮气转化率;I、II实验中氢气量相等,氮气量越多,氮气转化率减小,I中氮气转化率大于II中氮气转化率,故III、I、II中氮气转化率依次增大,A错误;
B、可逆反应的热化学方程式表示:1mol氮气和3mol氢气完全反应放出92.4kJ热量.根据可逆反应特点,3mol氢气和1mol氮气不能完全生成NH3.II生成的氨气量大于I,B项正确;
C、如果平衡不移动,III中氨气量是I中2倍,氨气体积分数相等.在恒容条件下,I容器加压变成III,增大压强,平衡向生成NH3方向移动,氨体积分数增大,C正确;
D、温度不变,平衡常数不变,三个容器中平衡常数相等,D错误;
故答案为:BC;
②TJ段未达到平衡,反应向生成氨方向进行,温度升高,反应加快,氨气体积分数增大;当J点达到平衡,JL段:该正反应是放热反应,升高温度,平衡向逆方向移动,促进氨分解,氨的体积分数减小.L点温度高于T点温度,两点的各物质浓度相等,所以,L点氨的正反应速率较大;
故答案为:平衡之前,反应向生成氨方向进行;该正反应是放热反应,平衡之后,升高温度,平衡向逆方向移动,促进氨分解,氨的体积分数减小;小于;
③由表可知,前5min生成氨气1mol,则v(NH3)=$\frac{1mol÷2L}{5min}$=0.1mol/(L•min),根据化学反应中速率之比等于系数之比,得出v(H2)=1.5v(NH3)=0.15mol/(L•min);
故答案为:0.15mol/(L•min);
④稀溶液总体积等于两种溶液体积之和.根据电荷守恒有:c(NH4+)+c(H+)=c(OH-)+2c(SO42-),当溶液呈中性时c(H+)=c(OH-)=1.0×10-7mol/L,推知:c(NH4+)=2c(SO42-),c(SO42-)=0.5a mol/L,c(NH4+)=a mol/L,c(NH3•H2O)+c(NH4+)=0.5b mol/L,c(NH3•H2O)=(0.5b-a)mol/L.Kb=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{a×1{0}^{-7}}{0.5b-a}$=$\frac{2a}{(b-2a)×1{0}^{7}}$;
故答案为:$\frac{2a}{(b-2a)×1{0}^{7}}$;
(3)H2-2e-+2OH-=2H2O,根据能量密度定义,E=$\frac{\frac{1.2V×\frac{1000g}{2g/mol×2×96500C/mol}}{1kg}}{3.6×1{0}^{6}J•k{W}^{-1}•{h}^{-1}}$=32.2kW•h•kg-1,故答案为:$\frac{\frac{1.2V×\frac{1000g}{2g/mol×2×96500C/mol}}{1kg}}{3.6×1{0}^{6}J•k{W}^{-1}•{h}^{-1}}$=32.2kW•h•kg-1.
点评 本题综合考查学生化学反应速率的计算、化学平衡移动原理的应用、溶液中离子浓度之间的关系等知识,注意知识的归纳和梳理是解题的关键,题目难度大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 近年来发现用铈(Ce)的氧化物可高效制取H2,制备原理如图所示,已知0<δ<2,下列说法不正确的是( )
近年来发现用铈(Ce)的氧化物可高效制取H2,制备原理如图所示,已知0<δ<2,下列说法不正确的是( )| A. | 太阳能最终转变为化学能 | B. | CeO2是水分解的催化剂 | ||
| C. | T<1050℃时,CeO2-δ比CeO2稳定 | D. | 两步反应均属于氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.

 扑热息痛的结构简式为
扑热息痛的结构简式为


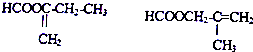
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
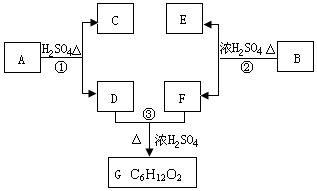 A、B、C、D、E、F和G都是有机化合物,它们的关系如图所示:
A、B、C、D、E、F和G都是有机化合物,它们的关系如图所示: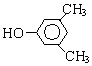 或
或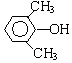 或
或 (写出一种即可).
(写出一种即可). 或
或
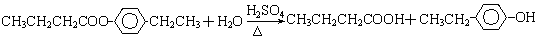 .①反应的反应类型取代反应
.①反应的反应类型取代反应 或
或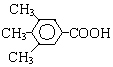 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
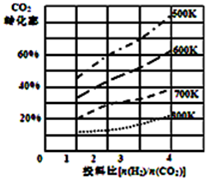 将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(l)
将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(l)| P1 | P2 | P3 | |
| I.2.0molCO2 6.0molH2 | 0.10mol | 0.04mol | 0.02mol |
| Ⅱ.1.0mol CO2 3.0molH2 | X1 | Y1 | Z1 |
| Ⅲ.1.0molCH3OCH3 3.0molH2O | X2 | Y3 | Z2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.85gNaCl晶体中含有0.1 NA 个Na+ | |
| B. | 1molFeCl3 完全水解转化为Fe(OH)3胶体后能生成NA个胶体粒子 | |
| C. | 过量的Zn与含1molH2SO4的稀H2SO4完全反应,转移的电子数一定为2NA | |
| D. | 一定量的Fe 与含1molHNO3的稀HNO3恰好完全反应,被还原的氮原子数小于NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com