
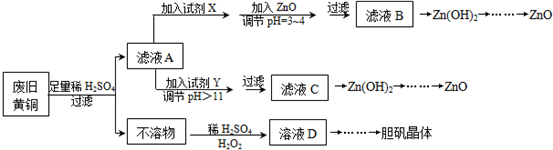
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 沉淀完全的pH | 3.0 | 8.8 | 8.9 |
| 0.4850g |
| 0.5000g |


科目:高中化学 来源: 题型:
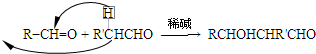
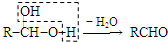
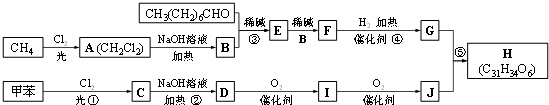
查看答案和解析>>
科目:高中化学 来源: 题型:
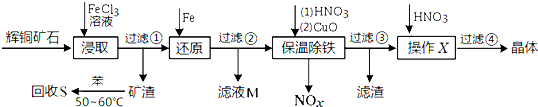
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
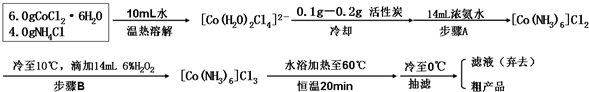
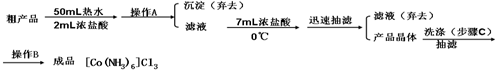
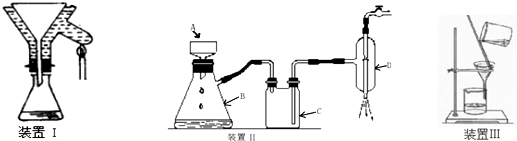
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al具有良好的延展性和抗腐蚀性,可制成铝箔包装物品 |
| B、NaHCO3能与碱反应,食品工业用作焙制糕点的膨松剂 |
| C、晶体硅是半导体材料,可用于计算机芯片的基底 |
| D、K2FeO4能与水作用生成Fe(OH)3胶体和O2,可用于自来水的净化和杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠在水层中反应并四处游动 |
| B、钠停留在苯层中不发生反应 |
| C、钠在苯的液面上反应并四处游动 |
| D、钠在苯与水的界面处反应并可能上下跳动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com