
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,KOH作为电解质.下列关于该燃料电池的叙述不正确的是

A.电流从右侧电极经过负载后流向左侧电极
B.负极发生的电极反应式为N2H4+4OH--4e-=N2+4H2O
C.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极 表面的吸附量,并使它们与电解质溶液充分接触
D.该燃料电池持续放电时,K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜
D
【解析】
试题分析:A、根据装置图可知,通入空气的一极是正极,发生还原反应,通入肼的一极是负极,发生氧化反应,电流从正极流向负极,所以电流从右侧电极经过负载后流向左侧电极,正确;B、负极是肼失去电子生成氮气的反应,结合电解质溶液,所以电极反应式是N2H4+4OH--4e-=N2+4H2O,正确;C、该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触,加快反应速率,正确;D、原电池中,阳离子向正极移动,所以K+从负极向正极迁移,但右侧负极中结合氢氧根离子,正极产生氢氧根离子,所以氢氧根离子通过交换膜移动到负极,离子交换膜需选用阴离子交换膜,错误,答案选D。
考点:考查原电池的反应原理


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015江苏省盐城市高二12月月考化学试卷(解析版) 题型:填空题
⑵(12分) 18℃时,H2A(酸):K1=4.3×10-7,K2=2.1×10-12。H2B(酸):K1=1.0×10-7,K2=6.3×10-13,在浓度相同的两种溶液中,用“>”、“<”或“=”填空。
①H+的浓度:H2A________H2B;
②酸根离子的浓度:c (A2-)________c (B2-);
③酸分子的浓度:c (H2A)________c (H2B);
④溶液的导电能力:H2A________H2B。
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省高一上学期第二次月考化学试卷(解析版) 题型:选择题
硅被誉为无机非金属材料的主角。据2001年12月的《参考消息》报道,有科学家提出硅是“21世纪的能”、“未的石油”。下列有关说法正确的是
A.硅在地壳中含量居第二位,在地球上有丰富的硅资,如石英、水晶、玛瑙的主要成分都是单质硅
B.在野外,用硅、烧碱的混合物可以制取氢气
C.硅的性质稳定,不与任何酸反应
D.硅是一种良好的半导体材料,所以是制造光导纤维的基本原料
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市高三上学期期末理综化学试卷(解析版) 题型:填空题
【物质结构与性质】(15分)钙的化合物在工农业生产和生活中有广泛的应用.
(1)已知CaC2与水反应生成乙炔.请回答下列问题:
①将乙炔通入[Cu(NH3)2]Cl溶液中生成Cu2C2红棕色沉淀,Cu+基态核外电子排布式为___________________.
②CaC2中C22-与O22+互为等电子体,1molO22+中含有的π键数目为_________.
③乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N).丙烯腈分子中碳原子轨道杂化类型是_______________,构成丙烯腈元素中第一电离能最大的是__________.
(2)抗坏血酸钙的组成为Ca(C6H7O6)2?4H2O,其结构示意图如图1:

该物质中存在的化学键类型包括____________(填字母).
A.金属键 B.离子键 C.非极性共价键 D.配位键
(3)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图2所示:由此可判断该钙的氧化物的化学式为____________.已知阿伏加德罗常数为NA,该晶体的密度为ρg·cm3,则晶胞中两Ca2+间的最近距离为______________cm.(用含NA、ρ的代数式表示)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市高三上学期期末理综化学试卷(解析版) 题型:选择题
能用如图气体制取装置制取少量气体并能“随开随用、随关随停”的是

A.大理石和稀硫酸制取二氧化碳
B.锌粒和稀硫酸制氢气
C.浓盐酸和二氧化锰制取氯气
D.过氧化钠和水制取氧气
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三质量检测化学试卷(解析版) 题型:填空题
(12分)钛酸钡粉体是电子陶瓷元器件的重要基础原料。工业以草酸盐共沉淀法获得草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧可获得钛酸钡粉体。

(1)酸浸时发生的反应的离子方程式为 ;为提高BaCO3的酸浸率,可采取的措施为 (任答一点)。
(2)配制TiCl4溶液时,通常将TiCl4溶于浓盐酸,目的是 。
(3)加入H2C2O4溶液时,发生反应的化学方程式为 ;
可循环使用的物质X是 。
(4)煅烧得到BaTiO3的同时,生成高温下的气体产物有CO、 和 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南京市、盐城市高三一模化学试卷(解析版) 题型:填空题
[物质结构与性质]乙烯酮 (CH2=C=O)是一种重要的有机中间体,可由C2H2和O2的混合气体通过锌、钙、银的三种金属的氧化物(催化剂)反应得到。也可用CH3COOH在痕量(C2H5O)3P=O存在下加热脱H2O得到。
(1)Zn2+基态核外电子排布式为 。
(2)与H2O互为等电子体的一种阴离子为 ;乙烯酮分子中碳原子杂化轨道类型有 。
(3)CH3COOH的沸点比HCOOCH3的高,其主要原因是 。
(4)lmol(C2H5O)3P=O分子中含有的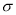 键的数目为 。
键的数目为 。
(5)Ag的氧化物的晶胞结构如图所示,

该氧化物的化学式为 .
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省连云港等四市高三一模化学试卷(解析版) 题型:选择题
下列有关化学用语的表示正确的是
A.NH4Cl的电子式: B.Cl-的结构示意图:
B.Cl-的结构示意图:
C.中子数为21的钾原子:40 19K D.对硝基苯酚的结构简式:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com