
【题目】下列叙述中正确的是( )
A. 相对分子质量相同、结构不同的化合物一定是互为同分异构体关系
B. 结构对称的烷烃,其一氯代物必定只有一种结构
C. 互为同分异构体的化合物不可能具有相同的结构简式
D. 通式为CnH2n且碳原子数不同的有机物一定互为同系物
科目:高中化学 来源: 题型:
【题目】下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。请填写下列空白:

(1)写出下列物质的化学式:
A________,B________,C________。
(2)写出下列反应的离子方程式、化学方程式:
A→C(离子方程式)___________________________________________________,
B→D(化学方程式)____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题:
(1)写出下列反应的化学方程式:
①乙烯通入到溴的四氯化碳溶液中:_____________________。
②苯与浓硝酸、浓硫酸混合后加热至50℃~60℃发生反应:__________________。
(2)给下列有机物命名:
①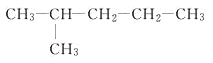 _______________________
_______________________
②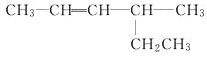 _____________________
_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对三联苯是一种有机合成中间体,工业上合成对三联苯的化学方程式为![]() 。下列说法不正确的是( )
。下列说法不正确的是( )
A. 上述反应属于取代反应
B. 对三联苯分子中至少有16个原子共平面
C. 对三联苯的一氯取代物有4种
D. 0.2 mol对三联苯在足量的氧气中完全燃烧消耗5.1 mol O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子.如图分子,因其形状像东方塔式庙宇(pagoda﹣style temple),所以该分子也就称为pagodane(庙宇烷),有关该分子的说法正确的是( )
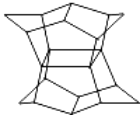
A. 分子式为C20H20
B. 一氯代物的同分异构体只有两种
C. 分子中含有二个亚甲基(﹣CH2﹣)
D. 分子中含有4个五元碳环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化碳、二氧化碳的利用具有十分重要的意义,科学家提出以下几个设想:
Ⅰ.二氧化碳与氢气在催化剂作用下可制取低碳烯烃。在一恒容密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。
C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。

(1)△H____________ (填“>”“<”或“不能确定”)0。
(2)若测试中体系内无氧气产生,试结合图示推断热稳定性:C2H4_______(填“>” “<”或“不能确定”)H2O。
Ⅱ.甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应 | 平衡 常数 | 温度℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
(1)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系,如左下图所示。则平衡状态由A变到B时,平衡常数K(A)_____________K(B)(填“>”、“<”或“=”)。据反应①与②可推导出K1、K2与K3之间的关系,则K3=_______(用K1、K2表示)。

(2)在3 L容积可变的密闭容器中发生反应②,已知
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_____________________。
(3)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。

请写出加入(通入)b物质一极的电极反应式_________________;每消耗6.4g甲醇转移的电子数为_______________。
(4)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合后,溶液中:2c(Ba2+)= c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
①少量Cl2通入FeI2溶液中:Cl2+2I=2Cl+I2
②Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
③向次氯酸钙溶液中通入少量SO2:Ca2++2ClO+H2O+SO2=CaSO3↓+2HClO
④FeBr2溶液与等物质的量Cl2反应:2Fe2++2Br+2Cl2=2Fe3++4Cl+Br2
⑤向小苏打溶液中加入过量的澄清石灰水:HCO+Ca2++OH=CaCO3↓+H2O
⑥硫酸氢钠溶液与足量氢氧化钡溶液混合:H++SO![]() +Ba2++OH=BaSO4↓+H2O
+Ba2++OH=BaSO4↓+H2O
⑦Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH+O2↑
A. ①②⑤⑦ B. ①②③⑥ C. ③④⑤⑦ D. ①④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为电化学降解NO![]() 。下列说法中正确的是( )
。下列说法中正确的是( )
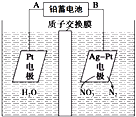
A. 铅蓄电池的A极为阴极
B. 电解的过程中有H+从右池移动到左池
C. 该电解池的阴极反应为:2NO3- + 6H2O + 12e- = N2↑ + 12OH-
D. 若电解过程中转移1moL电子,则交换膜两侧电解液的质量变化差为7.2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料。
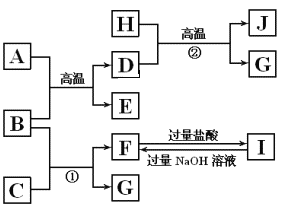
根据图示回答问题:
(1)写出下列物质的化学式:A ______,E______;
(2)反应①的化学方程式是_________________________ ;
反应②的化学方程式是___________________________ ;
(3)J与盐酸反应的化学方程式是______________________ ;
反应后的溶液与足量的D反应的离子方程式是______________________,如何检验最后溶液中的阳离子:______________________________________。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com