
【题目】某温度时,CuS,MnS在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( ) 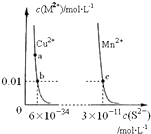
A.该温度下,Ksp(CuS)小于Ksp(MnS)
B.向CuSO4溶液中加入MnS发生如下反应:Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq)
C.在含有CuS和MnS固体的溶液中c(Cu2+):c(Mn2+)为2×10﹣23:1
D.a点对应的 Ksp大于b点对应的Ksp
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】铁红(主要成分为Fe2O3)是一种用途广泛的颜料,用废铁屑制备铁红的流程如下:

(1)操作Ⅰ的名称是_________。
(2)检验FeCO3沉淀是否洗净的实验方法是________。
(3)加入NH4HCO3溶液的反应除了生成FeCO3沉淀,还会生成一种气体,生成气体的离子方程式为________。
(4)在空气中煅烧FeCO3的化学方程式是________,若煅烧不充分,产品Fe2O3中会有FeO,为了避免产品中有FeO,可以采取的措施是________。
(5)称取3.0 g 产品,用稀硫酸溶解,逐滴加入0.10 mol·L-1 KMnO4溶液20.00 mL,二者恰好反应完全。若此产品中只含有FeO、Fe2O3,求算产品中Fe2O3的质量分数,写出计算过程___。
(已知:10FeSO4+2KMnO4+8H2SO4===5Fe2(SO4)3+2MnSO4+K2SO4+8H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应为N2+3H22NH3 , 今有A、B、C、D四个容器,每个容器中有两种操作,两种操作分别达到平衡后,操作1中N2和操作2中NH3转化率之和一定不为1的是(起始体积相等)( )
A.恒温恒容:操作1:加1 mol N2+3 molH2 , 操作2:加2 mol NH3
B.恒温恒压:操作1:加1 mol N2+3 molH2 , 操作2:加2 mol NH3
C.恒温恒容:操作1:加1 mol N2+3 molH2 , 操作2:加3 mol NH3
D.恒温恒压:操作1:加1 mol N2+3 molH2 , 操作2:加3 mol NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如右图所示。则下列离子组在对应的溶液中一定能大量共存的是

A.a点对应的溶液中:Na+、AlO2-、SO42-、NO3-
B.b点对应的溶液中:Ba2+、K+、NO3-、Cl-
C.c点对应的溶液中:Na+、Ag+、Mg2+、NO3-
D.d点对应的溶液中:Cl-、NO3-、Fe2+、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据中央电视台报道,近年我国的一些沿江城市多次出现大雾天气,致使高速公路关闭,航班停飞,雾属于下列哪种分散系
A. 乳浊液 B. 溶液 C. 胶体 D. 悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气.为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,反应装置略去).
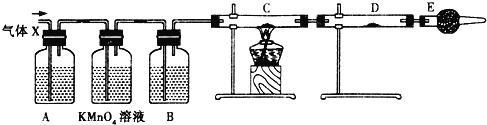
注:C中为氧化铜粉末,试回答下列问题:
(1)上述反应中生成二氧化硫的化学方程式为:________________________________;
(2)乙同学认为还可能产生氢气的理由是:____________________________________;
(3)丙同学在安装好装置后,必不可少的一步操作是:__________________________;
(4)A中试剂是______,D中试剂是______;
(5)E装置的作用是_________________________;
(6)可以证明气体X中含有氢气的实验现象是:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的性质,设计了如下的实验装置。
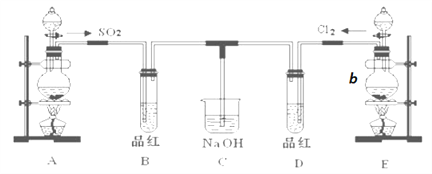
(1)实验室用装置A制备SO2。试剂组合最好是________。
a.稀 H2SO4+Cu b.浓HNO3+Na2SO3 c.70% H2SO4+K2SO3
(2)实验室用装置E制备Cl2,仪器b中装有MnO2粉末。写出仪器b的名称_______,该实验制备Cl2的化学方程式 ___________________________。若该反应消耗8.7g氧化剂,则参加反应的还原剂的物质的量为_____________mol;
(3)反应开始一段时间后,观察到B试管中的品红溶液出现的现象是:_____________;完全反应后,停止通气,再给D试管加热,D试管现象是__________________。
(4)C装置的作用是_______________________。
(5)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液M中含有MgCl2、KCl和AlCl3,某小组用下图所示过程对其进行处理以获得较纯净的AlCl3溶液。已知:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,请回答:
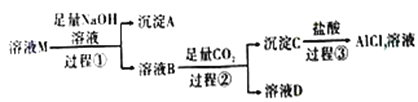
(1)沉淀A的化学式为_______,过程①中Al3+发生反应的离子方程式为_______。
(2)上述过程中的氢氧化钠溶液_____(填“能”或“不能”)用氨水代替,原因是_______。
(3)溶液B中大量存在的阳离子是______,过程③反应的离子方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超细碳酸钙的应用非常广泛。下图为工业生产超细碳酸钙的流程图:

(1)反应池中发生反应的化学方程式为___________。
(2)将反应池中得到的固体过滤、洗涤、烘干,得到超细碳酸钙。判断固体是否洗净的操作是__________。
(3)实验小组在实验室中利用如图所示装置(部分夹持装置已略去)模拟侯氏制碱法制纯碱。

实验步骤:
I.食盐精制:粗盐(含少量Ca2+、Mg2+、SO32-)溶解,依次加入足量NaOH溶液、______溶液、_______溶液;过滤;加入盐酸调pH至7。
II.转化:①将精制后的食盐溶液控制温度在30~35℃之间;不断搅拌,先后通入足量氨气和二氧化碳气体;保温,搅拌半小时;
②静置,过滤、洗涤、烘干,得到NaHCO3晶体。
III.制纯碱:将制得的NaHCO3放入坩埚中,在酒精灯上灼烧,冷却至室温,即得到纯碱。
已知各物质在不同温度下的溶解度见右表。
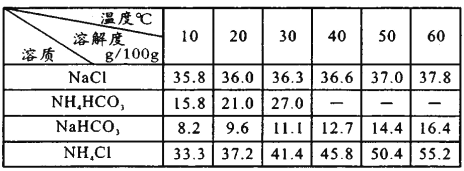
①B中应盛装________。
②C装置中发生“转化”生成NaHCO3的离子方程式是___________。
③“转化”过程中,温度控制在30~35℃之间的加热方式是_______;温度需控制在30~35℃之间的原因是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com