
【题目】超细碳酸钙的应用非常广泛。下图为工业生产超细碳酸钙的流程图:

(1)反应池中发生反应的化学方程式为___________。
(2)将反应池中得到的固体过滤、洗涤、烘干,得到超细碳酸钙。判断固体是否洗净的操作是__________。
(3)实验小组在实验室中利用如图所示装置(部分夹持装置已略去)模拟侯氏制碱法制纯碱。

实验步骤:
I.食盐精制:粗盐(含少量Ca2+、Mg2+、SO32-)溶解,依次加入足量NaOH溶液、______溶液、_______溶液;过滤;加入盐酸调pH至7。
II.转化:①将精制后的食盐溶液控制温度在30~35℃之间;不断搅拌,先后通入足量氨气和二氧化碳气体;保温,搅拌半小时;
②静置,过滤、洗涤、烘干,得到NaHCO3晶体。
III.制纯碱:将制得的NaHCO3放入坩埚中,在酒精灯上灼烧,冷却至室温,即得到纯碱。
已知各物质在不同温度下的溶解度见右表。
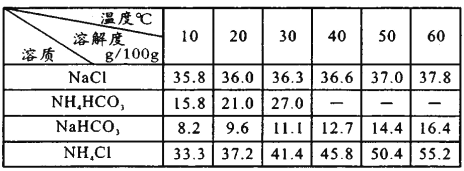
①B中应盛装________。
②C装置中发生“转化”生成NaHCO3的离子方程式是___________。
③“转化”过程中,温度控制在30~35℃之间的加热方式是_______;温度需控制在30~35℃之间的原因是_________。
【答案】 CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl 取最后一次洗涤液少许,加入硝酸酸化的硝酸银溶液,无明显现象,则已洗净,否则未洗净 氯化钡或BaCl2 碳酸钠或Na2CO3 饱和碳酸氢钠溶液 Na++CO2+H2O+NH3=NaHCO3↓+NH4+(或Na++HCO3-=NaHCO3↓) 水浴加热 温度过高造成NH4HCO3分解,温度过低NH4HCO3的溶解度小会析出,使产率偏低
【解析】(1)反应池中生成碳酸钙和氯化铵,发生反应的化学方程式为CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl。(2)得到超细碳酸钙表面含有氯离子,所以可以通过检验氯离子判断固体是否洗净,其操作是取最后一次洗涤液少许,加入硝酸酸化的硝酸银溶液,无明显现象,则已洗净,否则未洗净。(3)I. Ca2+用碳酸钠除去,Mg2+用氢氧化钠除去,SO42-用氯化钡除去,过滤后加入盐酸酸化。但由于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面,而氢氧化钠可以随意调整,即依次加入足量NaOH溶液、氯化钡溶液、碳酸钠溶液,过滤,加入盐酸调pH至7。①A装置制备二氧化碳,由于生成的二氧化碳中含有氯化氢,所以B中应盛装饱和碳酸氢钠溶液,用来除去二氧化碳中的氯化氢。②C装置中生成NaHCO3的离子方程式是Na++CO2+H2O+NH3=NaHCO3↓+NH4+。③“转化”过程中,温度控制在30~35℃之间的加热方式是水浴加热;根据表中数据可知温度过高造成NH4HCO3分解,温度过低NH4HCO3的溶解度小会析出,使产率偏低,所以温度需控制在30~35℃之间。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某温度时,CuS,MnS在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( ) 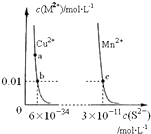
A.该温度下,Ksp(CuS)小于Ksp(MnS)
B.向CuSO4溶液中加入MnS发生如下反应:Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq)
C.在含有CuS和MnS固体的溶液中c(Cu2+):c(Mn2+)为2×10﹣23:1
D.a点对应的 Ksp大于b点对应的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的分离和提纯在生产和研究中都有重要的应用,请回答:
(1)填写下图中有关仪器的名称:A_______ 、B_____________。
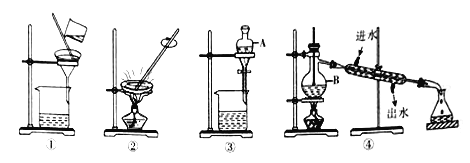
(2)装置④可以进的分离提纯操作是______(填操作名称),其中明显的错误是__________。
(3)下列做法正确的是_______(填字母)。
A.分离花生油和水应选装置④
B.粗盐提纯时可选装置①和②
C.用CCl4提取碘水中的碘应选装置③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得: 3SiO2(s)+6C(s)+2N2(g)═Si3N4(s)+6CO(g)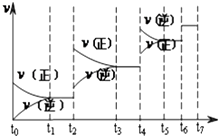
(1)该反应的平衡常数表达式为K=
(2)若知上述反应为放热反应,则其反应热△H0(填“>”、“<”或“=”);升高温度,其平衡常数值(填“增大”、“减小”或“不变”); 若已知CO生成速率为v(CO)=18molL﹣1min﹣1 , 则N2消耗速率为v(N2)=
(3)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图.图中t4时引起平衡移动的条件可能是;
(4)图中表示平衡混合物中CO的含量最高的一段时间是 .
(5)已知:2H2(g)+O2(g)═2H2O(g);△H=﹣483.6kJmol﹣1;H2O(g)=H2O(l)△H=﹣44kJmol﹣1 , ;由此可知H2燃烧热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种常见的金属单质,A元素在地壳中含量位列第6,A的密度为0.97 g/cm3;B为紫红色固体,锈蚀时变为绿色;C在空气中加热熔化但不滴落;D在氧气中燃烧,火星四射。根据以上信息回答下列问题:
(1)写出对应化学式:A________,B________,C________,D________。
(2)A在室温下与氧气反应时生成________,D在空气中锈蚀生成的氧化物为________。
(3)写出下列化学方程式:
①A在空气中燃烧_______________________________________________________;
②B长期置于空气中变为绿色物质______________________________________________。
(4)将5 g钠铝合金投入到200 mL的水中,固体完全溶解,产生4.48 L标准状况下的气体,溶液中只有一种溶质。经过分析得出钠铝合金中两种金属的物质的量之比为________,所得溶液中溶质的物质的量浓度为____________(假设溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物之间的相互转化可用下式表示:![]()
回答下列有关问题:
(1)Fe与过量稀硫酸反应可以制取FeSO4 . 若用反应所得的酸性溶液,实现上述①的转化,要求产物纯净.可选用的试剂是 (选填序号);
a.Cl2 b.Fe c.HNO3 d.H2O2
(2)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺.精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+=Cu2++5Fe2++2S.(CuFeS2中S为﹣2价)则下列说法正确的是 (选填序号);
a.从物质分类的角度看,黄铜矿属于合金
b.反应中,所有铁元素均被还原
c.反应中,CuFeS2 既作氧化剂又作还原剂
d.当转移1mol电子时,46g CuFeS2参加反应
(3)下述反应中,若FeSO4和O2的系数比为2:1,试配平下列方程式: FeSO4+ K2O2→ K2FeO4+ K2O+ K2SO4+ O2↑
(4)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成Fe(OH)3 . 高铁酸钾作为水处理剂发挥的作用是 、 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com