
【题目】“千淘万漉虽辛苦。吹尽狂沙始得金”这里的“漉”是指
A. 过滤 B. 渗析 C. 蒸馏 D. 结晶
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的性质,设计了如下的实验装置。
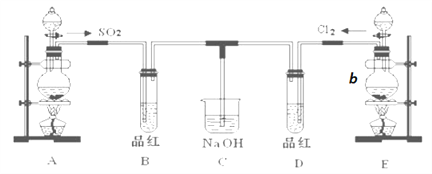
(1)实验室用装置A制备SO2。试剂组合最好是________。
a.稀 H2SO4+Cu b.浓HNO3+Na2SO3 c.70% H2SO4+K2SO3
(2)实验室用装置E制备Cl2,仪器b中装有MnO2粉末。写出仪器b的名称_______,该实验制备Cl2的化学方程式 ___________________________。若该反应消耗8.7g氧化剂,则参加反应的还原剂的物质的量为_____________mol;
(3)反应开始一段时间后,观察到B试管中的品红溶液出现的现象是:_____________;完全反应后,停止通气,再给D试管加热,D试管现象是__________________。
(4)C装置的作用是_______________________。
(5)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铜﹣锌﹣硫酸构成的原电池中,当导线中有1mol电子通过时,理论上的两极变化是( ) ①锌片溶解32.5g ②锌片增重32.5g ③铜片上析出1gH2④铜片上析出1mol H2 .
A.①③
B.①④
C.②③
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超细碳酸钙的应用非常广泛。下图为工业生产超细碳酸钙的流程图:

(1)反应池中发生反应的化学方程式为___________。
(2)将反应池中得到的固体过滤、洗涤、烘干,得到超细碳酸钙。判断固体是否洗净的操作是__________。
(3)实验小组在实验室中利用如图所示装置(部分夹持装置已略去)模拟侯氏制碱法制纯碱。

实验步骤:
I.食盐精制:粗盐(含少量Ca2+、Mg2+、SO32-)溶解,依次加入足量NaOH溶液、______溶液、_______溶液;过滤;加入盐酸调pH至7。
II.转化:①将精制后的食盐溶液控制温度在30~35℃之间;不断搅拌,先后通入足量氨气和二氧化碳气体;保温,搅拌半小时;
②静置,过滤、洗涤、烘干,得到NaHCO3晶体。
III.制纯碱:将制得的NaHCO3放入坩埚中,在酒精灯上灼烧,冷却至室温,即得到纯碱。
已知各物质在不同温度下的溶解度见右表。
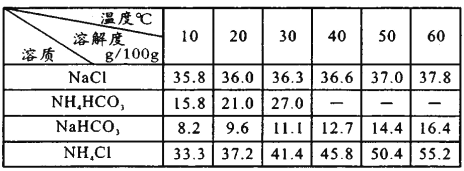
①B中应盛装________。
②C装置中发生“转化”生成NaHCO3的离子方程式是___________。
③“转化”过程中,温度控制在30~35℃之间的加热方式是_______;温度需控制在30~35℃之间的原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列无色溶液中一定能大量共存的离子组是
A. K+、Cu 2+、NO3-、SO42- B. K+、H+、I-、MnO4-
C. Mg2+、Na+、SO42-、OH- D. Na+、NH4+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应14CuSO4 +5FeS2 +12H2O=7Cu2S +5FeSO4+12H2SO4,下列结论正确的是
A. FeS2既不是氧化剂,又不是还原剂
B. Cu2S 既是氧化产物,又是还原产物
C. 被氧化的硫和被还原的硫质量比是7∶3
D. 被CuSO4氧化的硫占全部被氧化的硫的2/3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏伽德罗常数约为6.02×1023 mol﹣1 , 下列说法正确的是( )
A.2.3 g钠与足量丙三醇反应,转移电子数为0.3×6.02×1023
B.标准状况下,22.4 L乙醇的共价键数为8×6.02×1023
C.标准状况下,5.6 L甲醛所含的电子数为4×6.02×1023
D.100 mL 1 molL﹣1醋酸溶液中,H+的个数为0.1×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下A、B、C的如图所示的转化关系,且△H=△H1+△H2 . 则A、C可能是( ) 
①Fe、FeCl3
②C、CO2
③AlCl3、NaAlO2
④NaOH、NaHCO3
⑤S、SO3
⑥Na2CO3、CO2 .
A.②③④⑥
B.②③④⑤⑥
C.①②③④⑥
D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表所示:
实验编号 | HA物质的量浓度(mol*L﹣1) | NaOH物质的量浓度(mol*L﹣1) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH<7 |
请回答:
(1)从①组情况表明,HA是(填“强酸”或“弱酸”).
(2)②组情况表明,c0.2(选填“大于”、“小于”或“等于”).混合液中离子浓度c(A﹣)与c(Na+)的大小关系是 .
(3)从③组实验结果分析,说明HA的电离程度NaA的水解程度(选填“大于”、“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是 .
(4)①组实验所得混合溶液中由水电离出的c(OH﹣)与溶液中的c(OH﹣)之比为 . 写出该混合溶液中下列算式的精确结果(不能近似计算):c(Na+)﹣c(A﹣)=molL﹣1 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com