
【题目】一定条件下A、B、C的如图所示的转化关系,且△H=△H1+△H2 . 则A、C可能是( ) 
①Fe、FeCl3
②C、CO2
③AlCl3、NaAlO2
④NaOH、NaHCO3
⑤S、SO3
⑥Na2CO3、CO2 .
A.②③④⑥
B.②③④⑤⑥
C.①②③④⑥
D.①②③④⑤⑥
【答案】A
【解析】解:①Fe ![]() FeCl3,不存在上述转化,故①错误;②由C+O2
FeCl3,不存在上述转化,故①错误;②由C+O2 ![]() CO2,可看成C+
CO2,可看成C+ ![]() O2
O2 ![]() CO、CO+
CO、CO+ ![]() O2
O2 ![]() CO2来完成,A为C,C为CO2,符合△H=△H1+△H2,故②正确;③由AlCl3+4NaOH═3NaCl+NaAlO2+2H2O,可看成AlCl3+3NaOH═Al(OH)3↓+3NaCl、Al(OH)3+NaOH═NaAlO2+2H2O来完成,A为AlCl3,C为NaAlO2,符合△H=△H1+△H2,故③正确;④由NaOH+CO2═NaHCO3,可看成2NaOH+CO2═Na2CO3+H2O、Na2CO3+H2O+CO2═2NaHCO3来完成,A为NaOH,C为NaHCO3,符合△H=△H1+△H2,故④正确;⑤因S与氧气反应生成二氧化硫,不会直接生成三氧化硫,则不符合转化,故⑤错误;⑥由Na2CO3 +2HCl=2NaCl+CO2↑+H2O,可看成Na2CO3+HCl═NaCl+NaHCO3,NaHCO3 +HCl=NaCl+CO2↑+H2O的完成的,A为Na2CO3,C为NaCl,符合△H=△H1+△H2,故⑥正确;
CO2来完成,A为C,C为CO2,符合△H=△H1+△H2,故②正确;③由AlCl3+4NaOH═3NaCl+NaAlO2+2H2O,可看成AlCl3+3NaOH═Al(OH)3↓+3NaCl、Al(OH)3+NaOH═NaAlO2+2H2O来完成,A为AlCl3,C为NaAlO2,符合△H=△H1+△H2,故③正确;④由NaOH+CO2═NaHCO3,可看成2NaOH+CO2═Na2CO3+H2O、Na2CO3+H2O+CO2═2NaHCO3来完成,A为NaOH,C为NaHCO3,符合△H=△H1+△H2,故④正确;⑤因S与氧气反应生成二氧化硫,不会直接生成三氧化硫,则不符合转化,故⑤错误;⑥由Na2CO3 +2HCl=2NaCl+CO2↑+H2O,可看成Na2CO3+HCl═NaCl+NaHCO3,NaHCO3 +HCl=NaCl+CO2↑+H2O的完成的,A为Na2CO3,C为NaCl,符合△H=△H1+△H2,故⑥正确;
故选A.


科目:高中化学 来源: 题型:
【题目】物质的分离和提纯在生产和研究中都有重要的应用,请回答:
(1)填写下图中有关仪器的名称:A_______ 、B_____________。
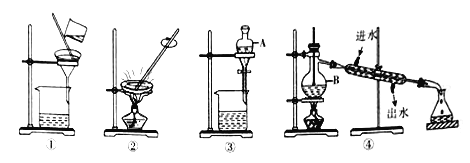
(2)装置④可以进的分离提纯操作是______(填操作名称),其中明显的错误是__________。
(3)下列做法正确的是_______(填字母)。
A.分离花生油和水应选装置④
B.粗盐提纯时可选装置①和②
C.用CCl4提取碘水中的碘应选装置③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用如图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)

回答下列问题:
(1)装置A中液体试剂选用________
(2)装置B的作用是_________________,装置C的作用是_________________________,装置E中碱石灰的作用是______________________________________________。
(3)装置D中发生反应的化学方程式是_________________________。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是

A.该硫酸试剂的物质的量浓度为18.4 mol/L
B.稀释该硫酸时应把水倒入硫酸中,边倒边搅拌
C.50 mL该H2SO4中加入足量的铜片并加热,被还原的H2SO4的物质的量为0.46 mol
D.标准状况下2.7 g Al与足量的该硫酸反应可得到H2 3.36 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义.利用硫铁矿烧渣制备铁红等产品的实验流程如下: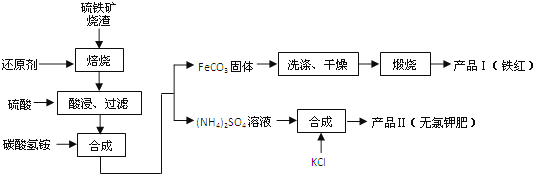
已知几种盐的溶解度随温度变化的曲线如下图所示:
回答下列问题:
(1)酸浸、过滤后滤液中的金属阳离子是 .
(2)煅烧FeCO3生成产品I的化学反应方程式为 .实验室进行煅烧操作所需仪器除了酒精灯、泥三角、三脚架、玻璃棒外,还有 .
(3)产品Ⅱ的化学式为 ,为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是: .
(4)检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液, .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物之间的相互转化可用下式表示:![]()
回答下列有关问题:
(1)Fe与过量稀硫酸反应可以制取FeSO4 . 若用反应所得的酸性溶液,实现上述①的转化,要求产物纯净.可选用的试剂是 (选填序号);
a.Cl2 b.Fe c.HNO3 d.H2O2
(2)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺.精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+=Cu2++5Fe2++2S.(CuFeS2中S为﹣2价)则下列说法正确的是 (选填序号);
a.从物质分类的角度看,黄铜矿属于合金
b.反应中,所有铁元素均被还原
c.反应中,CuFeS2 既作氧化剂又作还原剂
d.当转移1mol电子时,46g CuFeS2参加反应
(3)下述反应中,若FeSO4和O2的系数比为2:1,试配平下列方程式: FeSO4+ K2O2→ K2FeO4+ K2O+ K2SO4+ O2↑
(4)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成Fe(OH)3 . 高铁酸钾作为水处理剂发挥的作用是 、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的两种物质作用时,反应条件或反应物用量的改变,对生成物没有影响的是
A. Na2O2和H2O B. Na和O2 C. Ca(OH)2和CO2 D. C和O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com