
【题目】纯碱是一种重要的化工原料,目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题。
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:___。
(2)写出“联合制碱法”中有关反应的化学方程式:_____________、___________。
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?________。
(4)“联合制碱法”是对“氨碱法”的改进,其相对优点有___________ (填字母序号)。
A. 提高了原料利用率
B. 降低了生产成本
C. 减少了环境污染
D. 减轻了对设备的腐蚀
(5)产品纯碱中常含有碳酸氢钠,如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,已知所取产品的质量为m1g,加热后所剩固体的质量为m2g,则纯碱中碳酸氢钠的质量分数可表示为__。
【答案】2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl 2NaHCO3
2NH3↑+CaCl2+2H2O NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl 2NaHCO3![]() Na2CO3+CO2↑+H2O “氨碱法”中CO2来源于石灰石的煅烧,“联合制碱法”中CO2来源于合成氨工业的废气 A、B、C w(NaHCO3)=
Na2CO3+CO2↑+H2O “氨碱法”中CO2来源于石灰石的煅烧,“联合制碱法”中CO2来源于合成氨工业的废气 A、B、C w(NaHCO3)=![]() ×100%
×100%
【解析】
(1)氨碱法向母液中加入Ca(OH)2时发生反应:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,产生CaCl2;
CaCl2+2NH3↑+2H2O,产生CaCl2;
(2)联合制碱法的反应原理是NH3+H2O+CO2+NaCl=NaHCO3↓+NH4Cl;2NaHCO3![]() Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;
(3)联合制碱法中CO2来源于合成氨工业的废气,而氨碱法CO2来源于煅烧石灰石;
(4)联合制碱法相比于氨碱法,
A.氨碱法的最大缺点在于原料食盐的利用率只有72%~74%,联合制碱法最大的优点是使食盐的利用率提高到96%以上;
B.氨碱法:以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱,联合制碱法:以食盐、氨和二氧化碳(其中二氧化碳来自合成氨厂用水煤气制取氢气时的废气)为原料来制取纯碱,氨碱法循环物质:氨气、二氧化碳,联合制碱法循环物质:氯化钠、二氧化碳,最大的优点是把合成氨和纯碱两种产品联合起来,降低了成本;
C.联合制碱法最大的优点是使食盐的利用率提高到96%以上,没有废弃物产生并有可作为化肥的NH4Cl的副产品产生;
D.联合制碱法把合成氨和纯碱两种产品联合起来,回收循环使用氯化钠,二氧化碳,设备利用率高,加大了对设备的腐蚀,故D错误;
答案选ABC;
(5)根据反应:
2NaHCO3![]() Na2CO3+H2O+CO2↑ Δm
Na2CO3+H2O+CO2↑ Δm
168 106 168-106=62
m(NaHCO3) (m1-m2)g
解得m(NaHCO3)=![]() (m1-m2)g
(m1-m2)g
故NaHCO3的质量分数:![]() ×100%=
×100%=![]() ×100%。
×100%。


科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA。下列说法不正确的是
A.常温常压下,2 g D2O 中含中子数为NA
B.1mol苯乙烯(![]() )分子中含有碳碳双键的个数为4 NA
)分子中含有碳碳双键的个数为4 NA
C.0.5mol羟基中所含电子数为4.5NA
D.28g乙烯和丙烯(C3H6)的混合气体含有的碳原子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水的电离平衡曲线如图所示,试回答下列问题:

(1)图中五点KW间的关系是__________________.
(2)若从A点到D点,可采用的措施是________.
a.升温 b.加入少量的NaOH c.加入少量的NH4Cl
(3)E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为________.
(4)25℃时,体积为Va、pH=a的某一元强酸溶液与体积为Vb、pH=b的某一元强碱溶液均匀混合后,溶液的pH=7,已知b=2a,Va<Vb, 则a的取值范围为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业和生活中产生的废气![]() 、
、![]() 、
、![]() 对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。
对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。
(1)已知甲烷的燃烧热为![]() ;1mol水蒸气变成液态水放热
;1mol水蒸气变成液态水放热![]() :
:![]()
![]() ,则
,则![]()
![]() ____________。
____________。
(2)汽车尾气中含有![]() 和
和![]() ,某研究小组利用反应:2CO(g)+2NO(g)
,某研究小组利用反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g)实现气体的无害化排放。T℃时,在恒容的密闭容器中通入一定量的
N2(g)+2CO2(g)实现气体的无害化排放。T℃时,在恒容的密闭容器中通入一定量的![]() 和
和![]() ,能自发进行上述反应,测得不同时间的
,能自发进行上述反应,测得不同时间的![]() 和
和![]() 的浓度如表:
的浓度如表:
时间 | 0 | 1 | 2 | 3 | 4 | 5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
①0到2s内用![]() 表示的化学反应速率为______,该温度下,反应的平衡常数K1=______。
表示的化学反应速率为______,该温度下,反应的平衡常数K1=______。
②若该反应在恒容绝热条件下进行,再次达到平衡后的平衡常数为K2,则K1______ K2(填“>”、“<”'或“=”)。
(3)一定条件下,通过下列反应可实现燃煤烟气中硫的回收2CO(g)+SO2(g)![]() S(s)+2CO2(g) △H<0
S(s)+2CO2(g) △H<0
若向![]() 恒容密闭容器中通入
恒容密闭容器中通入![]() 和
和![]() ,反应在不同条件下进行上述反应,反应体系总压强随时间变化如图所示,与实验a相比,span>b组、c组分别改变的实验条件可能是 ____________、____________。
,反应在不同条件下进行上述反应,反应体系总压强随时间变化如图所示,与实验a相比,span>b组、c组分别改变的实验条件可能是 ____________、____________。

(4)常温下,用![]() 溶液作
溶液作![]() 捕捉剂可以降低碳排放。若某次捕捉后得到pH=10的溶液,则溶液中
捕捉剂可以降低碳排放。若某次捕捉后得到pH=10的溶液,则溶液中![]() ____________。(常温下
____________。(常温下![]() 、
、![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图用石墨作电极的电解池中,放入500mL含—种溶质的某蓝色硫酸盐溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成。请回答下列问题:
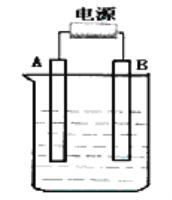
(1)写出电解时反应的总离子方程式____________________。
(2)若当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重6g。电解后溶液的pH为_____________。要使电解后溶液恢复到电解前的状态,则需加入_____________,其质量为_____________g。(假设电解前后溶液的体积不变)
(3)若原溶液为1L K2SO4、CuSO4的混合溶液,且c (SO42-) =2.0mol/L;如图装置电解,当两极都收集到22.4L气体(标准状况)时,停止电解。则原溶液中的c(K+)=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室干馏煤的装置图,结合下图回答问题。

(1)指出图中仪器名称:a__________;b__________;c__________;d__________。
(2)装置c的作用是____________________________________,d中的液体有________和________。有机物可以通过________的方法使其中的重要成分分离出来。
(3)e处点燃的气体是________,火焰的颜色是________色。
(4)下列叙述错误的是________。
A.煤发生了化学变化
B.d中液体显碱性
C.d中液体不分层
D.e处的气体可以还原氧化铜,也可以使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。
已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O

回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是____________。
(2)装置B的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象____________。
(3)装置C中表现了SO2的____________性;装置D中表现了SO2的____________性,装置D中发生反应的化学方程式为____________。
(4)F装置的作用是____________,漏斗的作用是____________。
(5)E中产生白色沉淀,该白色沉淀的化学成分为____________(填编号,下同),设计实验证明你的判断____________。
A.BaSO3 B.BaSO4 C.BaSO3和BaSO4
(6)工厂煤燃烧产生的烟气若直接排放到空气中,引发的主要环境问题有____________。
A.温室效应 B.酸雨 C.粉尘污染 D.水体富营养化
工业上为实现燃煤脱硫,常通过煅烧石灰石得到生石灰,以生石灰为脱硫剂,与烟气中SO2反应从而将硫固定,其产物可作建筑材料。写出其中将硫固定的化学方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法处理CO2和SO2混合污染气的原理如下图所示,电解质为熔融碳酸盐和硫酸盐,通电一段时间后,Ni电极表面形成掺杂硫的碳积层。下列说法错误的是

A. Ni电极表面发生了还原反应
B. 阳极的电极反应为:2O2—-4e-=O2
C. 电解质中发生的离子反应有:2SO2 +4O2—=2SO42—
D. 该过程实现了电解质中碳酸盐和硫酸盐的自补充循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,有下列四种溶液:
① | ② | ③ | ④ |
0.1 mol·L-1氨水 | pH=11氨水 | 0.1 mol·L-1盐酸 | pH=3盐酸 |
下列说法中正确的是( )
A. ①稀释到原来的100倍后,pH与②相同
B. 等体积①③混合、等体积②④混合所得的溶液都呈酸性
C. ①②中分别加入少量CH3COONa固体,![]() 的值都变小
的值都变小
D. ③④稀释到原来的100倍后,稀释后④溶液中的pH大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com