
【题目】25℃,101k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,辛烷的燃烧热为5518kJ/mol.下列热化学方程式书写正确的是( )
A.2H+(aq)+SO42﹣(aq)+Ba2+(aq)+2OH﹣(aq)=BaSO4(s)+2H2O(1);△H=﹣57.3 kJ/mol
B.KOH(aq)+ ![]() H2SO4(aq)=
H2SO4(aq)= ![]() K2SO4(aq)+H2O(l);△H=﹣57.3kJ/mol
K2SO4(aq)+H2O(l);△H=﹣57.3kJ/mol
C.C8H18(l)+ ![]() ?O2(g)=8CO2(g)+9H2O(g);△H=﹣5518 kJ/mol
?O2(g)=8CO2(g)+9H2O(g);△H=﹣5518 kJ/mol
D.2C8H18(g)+25O2(g)=16CO2(g)+18 H2O(1);△H=﹣5518 kJ/mol
【答案】B
【解析】解:A.中和热的概念酸跟碱发生中和反应而生成1mo水时的反应热,所以2H+(aq)+SO42﹣(aq)+Ba2+(aq)+2OH﹣(aq)═BaSO4(s)+2H2O(l)△H=﹣114.6kJ/mol,选项中焓变值应乘以2,故A错误; B.在稀溶液中,酸跟碱发生中和反应而生成1mo水,这时的反应热叫做中和热,故B正确;
C.反应热化学方程式中生成的水是气体,不是稳定氧化物,故C错误;
D.辛烷的燃烧热为5518kJ/mol,该热化学方程式中不是1mol物质燃烧,焓变值应乘以2,应为2C8H18(g)+25O2(g)=16CO2(g)+18 H2O(1);△H=﹣11036kJ/mol,故D错误;
故选B.


科目:高中化学 来源: 题型:
【题目】某无色溶滚中可能含有Na+、NH4+、Ba2+、Cu2+、SO42﹣、SO32﹣、Cl﹣、Br﹣、CO32﹣中的若干种.为检验其中含有的离子,进行如下实验:
①取10mL溶液,加入足量氯水,.无气体产生,再加入CCl4溶液分层,下层为橙扭色;
②分液后,将①中上层溶液加入足量BaCl2和HCl溶液,产生白色沉淀2.33g;
③另取10mL原溶液,加入过量的浓氢氧化钠溶液并加热,收集到标准状况下448m气体.下列关于原溶液的说法正确的是( )
A.肯定存在NH4+、Cl﹣、Br﹣
B.SO42﹣、SO32﹣至少含有一种
C.是否存在Na+需要通过焰色反应来确定
D.肯定不存在Ba2+、Cu2+、SO32﹣、CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)某温度时,2L的密闭容器中X、Y、Z=种气体物质的量随时间的变化如图 所示. 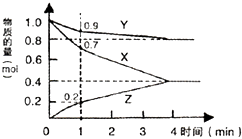
由图中数据分析,该反应的化学方程式为(用X、Y、Z表示),反应开始至1min,X的平均反应速率为 . 若4min时反应达到最大限度,Z的物质的量等于0.4 mol.此时,X的转化率为 , Y的物质的量浓度为
(2)可逆反应:2NO2(g)2NO(g)+O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是(填序号). ①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时生成2nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取钠﹣镁合金7.0克进行如下实验: 
(1)写出Mg在CO2中燃烧的化学方程式
(2)向溶液1中加过量的NaOH溶液,发生反应的离子方程式为
(3)写出合金的化学组成 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用学过的化学知识解答下列问题:
(1)下列反应中,属于吸热反应的是(填序号). ①煅烧石灰石 ②木炭燃烧 ③炸药爆炸 ④酸碱中和
⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(2)用铜、银与硝酸银设计一个原电池,此电池的正极是 , 负极的电极反应式是 .
(3)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25g,铜表面析出了氢气L(标准状况),导线中通过mol电子.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机化合物A只含有C、H两种元素,且能使酸性高锰酸钾溶液褪色.A、B、C、D、E有如下关系: 
(1)A中官能团的名称是 .
(2)B+D→E的反应类型是 . (填选项字母)
A.取代反应
B.加成反应
C.氧化反应
D.酯化反应
(3)写出B→C的化学方程式 .
(4)某课外小组设计实验制取E的装置如图所示. 
下列说法正确的是(填选项字母).
A.反应中浓硫酸的作用是催化剂、吸水剂
B.饱和碳酸钠溶液可用饱和氢氧化钠溶液代替
C.实验结束后烧杯中的溶液经振荡、静置、分液,能得到纯净的E
D.装置X的作用是能防止倒吸.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com