
【题目】用学过的化学知识解答下列问题:
(1)下列反应中,属于吸热反应的是(填序号). ①煅烧石灰石 ②木炭燃烧 ③炸药爆炸 ④酸碱中和
⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(2)用铜、银与硝酸银设计一个原电池,此电池的正极是 , 负极的电极反应式是 .
(3)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25g,铜表面析出了氢气L(标准状况),导线中通过mol电子.
【答案】
(1)①
(2)银;Cu﹣2e﹣=Cu2+
(3)1.12;0.1
【解析】解:(1)①煅烧石灰石属于吸热反应,所有的燃烧、炸药爆炸、酸碱中和、氧化钙溶于水以及食物的腐败均为放热反应,所以答案是:①;(2)根据金属的活泼性判断,铜作负极,铜失去电子变成离子进入溶液,发生氧化反应,Cu﹣2 e﹣=Cu2+;银作正极,银离子得电子生成银单质,发生还原反应,2Ag++2 e﹣=2Ag;两个电极反应式相加即得总反应方程式,Cu+2Ag+=2Ag+Cu2+ . 所以答案是:银; Cu﹣2e﹣=Cu2+;(3)解:用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,锌为负极,电极反应为:Zn﹣2e﹣=Zn2+ , 铜为正极,电极反应为2H++2e﹣=H2↑,锌片的质量减少了3.25克,则物质的量为 ![]() =0.05mol,转移的电子的物质的量为n(e﹣)=2n(Zn)=2n(H2)=2×0.05mol=0.1mol,则:V(H2)=0.05mol×22.4L/mol=1.12L,所以答案是:1.12;0.1.
=0.05mol,转移的电子的物质的量为n(e﹣)=2n(Zn)=2n(H2)=2×0.05mol=0.1mol,则:V(H2)=0.05mol×22.4L/mol=1.12L,所以答案是:1.12;0.1.
【考点精析】认真审题,首先需要了解吸热反应和放热反应(化学上把吸收热量的化学反应称为吸热反应;化学上把放出热量的化学反应称为放热反应).


科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验验证元素周期律.
(1)甲同学在a、b、c三只烧杯里分别加入50mL水,再分别滴加几滴酚酞溶液,依次加入大小相近的锂、钠、钾块,观察现象.甲同学设计实验的目的是;反应最剧烈的是 .
(2)乙同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强.他设计了如图装置以验证氮、碳、硅元素的非金属性强弱. 乙同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,可与铜反应;B是块状固体;打开分液漏斗的活塞后,可看到有大量气泡D产生;烧杯中可观察到白色沉淀C生成.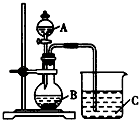
(i)写出下列物质的化学式:A、C、D .
(ii)写出烧杯中发生反应的离子方程式: .
(iii)碳、氮、硅三种元素的非金属性由强到弱顺序为 .
(iv)丙同学认为乙同学设计的实验不够严谨,应该在B和C之间增加一个洗气装置,该装置中应盛放(填试剂).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,101k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,辛烷的燃烧热为5518kJ/mol.下列热化学方程式书写正确的是( )
A.2H+(aq)+SO42﹣(aq)+Ba2+(aq)+2OH﹣(aq)=BaSO4(s)+2H2O(1);△H=﹣57.3 kJ/mol
B.KOH(aq)+ ![]() H2SO4(aq)=
H2SO4(aq)= ![]() K2SO4(aq)+H2O(l);△H=﹣57.3kJ/mol
K2SO4(aq)+H2O(l);△H=﹣57.3kJ/mol
C.C8H18(l)+ ![]() ?O2(g)=8CO2(g)+9H2O(g);△H=﹣5518 kJ/mol
?O2(g)=8CO2(g)+9H2O(g);△H=﹣5518 kJ/mol
D.2C8H18(g)+25O2(g)=16CO2(g)+18 H2O(1);△H=﹣5518 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①R﹣OH ![]() R﹣O﹣R′②
R﹣O﹣R′② ![]() ③C的化学式为C15H13NO4 , ﹣Bn含苯环但不含甲基.
③C的化学式为C15H13NO4 , ﹣Bn含苯环但不含甲基.
盐酸卡布特罗是一种用于治疗支气管病的药物,其中间体的合成路线如图:
(1)写出结构简式:AW .
(2)指出反应类型:反应① , 反应⑤ .
(3)反应②的总化学方程式(﹣Bn用具体结构代入) .
(4)写出所有同时符合下列条件的同分异构体:
①与A属于同系物 ②1H的核磁共振谱图只有4个峰 ③分子中碳原子数目等于10
(5)试利用上述合成路线的相关信息,由甲苯、(CH3)2NH等合成 ![]() (无机试剂任用)
(无机试剂任用)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲同时施用N、P、K三种化肥,下列组合中最适当的是:__________
①K2CO3 ②KCl ③Ca(H2PO4)2 ④NH3·H2O ⑤NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)在2L密闭容器内,800℃时发生反应:2NO(g)+O2(g)2NO2(g),在体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
NO的物质的量(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(i)上述反应在第5s时,NO的转化率为 .
(ii)用O2表示从0~2 s内该反应的平均速率v(O2)= .
(iii)能说明该反应已达到平衡状态的是 .
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内气体密度保持不变
(2)下表中的数据是破坏1mol物质中的化学键所消耗的能量:
物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
能量(kJ) | 243 | 193 | 151 | 431 | 366 | 298 | 436 |
根据上述数据回答下列问题:
(i)下列物质本身具有的能量最低的是 .
A.H2 B.Cl2 C.Br2 D.I2
(ii)下列氢化物中最稳定的是 .
A.HCl B.HBr C.HI
(iii)X2+H2=2HX(X代表Cl、Br、I)的反应是吸热反应还是放热反应? .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A只含有C,H,三种元素,16.8g该有机物经燃烧生成44.0g CO2和14.4g H2O2;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有C=O键和C=C键,核磁共振氢谱有三个峰,峰面积为6:1:1
(1)A的分子式是 . A的结构简式是;该分子中的含氧官能团的名称是 .
(2)下列物质中,一定条件能与A发生反应的;
A.H2
B.KMnO4
C.Br2
(3)该分子中在同一平面上的原子最多有个.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有4种碳架如下的烃,下列说法正确的是( ) ![]()
①a和d是同分异构体
②b和c是同系物
③a和d都能发生加成反应
④只有b和c能发生取代反应.
A.①④
B.①②
C.②③
D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素的性质呈现周期性变化的根本原因是
A. 元素的相对原子质量逐渐增大 B. 核外电子排布呈现周期性变化
C. 原子半径呈现周期性变化 D. 元素化合价呈现周期性变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com