
【题目】根据题意解答
(1)在2L密闭容器内,800℃时发生反应:2NO(g)+O2(g)2NO2(g),在体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
NO的物质的量(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(i)上述反应在第5s时,NO的转化率为 .
(ii)用O2表示从0~2 s内该反应的平均速率v(O2)= .
(iii)能说明该反应已达到平衡状态的是 .
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内气体密度保持不变
(2)下表中的数据是破坏1mol物质中的化学键所消耗的能量:
物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
能量(kJ) | 243 | 193 | 151 | 431 | 366 | 298 | 436 |
根据上述数据回答下列问题:
(i)下列物质本身具有的能量最低的是 .
A.H2 B.Cl2 C.Br2 D.I2
(ii)下列氢化物中最稳定的是 .
A.HCl B.HBr C.HI
(iii)X2+H2=2HX(X代表Cl、Br、I)的反应是吸热反应还是放热反应? .
【答案】
(1)65%;0.00125mol/(L?s);bc
(2)A;A;放热反应
【解析】解:(1)(i)根据表中数据知,3s时该反应已经达到平衡状态,则3s、5s时NO转化率相等,3s时参加反应的n(NO)=(0.020﹣0.007)mol=0.013mol,NO转化率= ![]() ×100%=
×100%= ![]() ×100%=65%,所以答案是:65%;(ii)v(NO)=
×100%=65%,所以答案是:65%;(ii)v(NO)= ![]() =0.0025mol/(Ls),同一可逆反应中同一段时间内各物质的反应速率之比等于其计量数之比,所以v(O2)=
=0.0025mol/(Ls),同一可逆反应中同一段时间内各物质的反应速率之比等于其计量数之比,所以v(O2)= ![]() v(NO)=
v(NO)= ![]() ×0.0025mol/(Ls)=0.0012 5 mol/(Ls),所以答案是:0.0012 5 mol/(Ls);(iii)a.v(NO2)=2v(O2)没有明确反应方向,所以不能据此判断平衡状态,故错误;b.反应前后气体的物质的量减小导致容器内压强减小,当容器内压强保持不变时,各物质的量不变,反应达到平衡状态,故正确;c.v逆(NO)=2v正(O2)=v正(NO),NO正逆反应速率相等,反应达到平衡状态,故正确; d.反应前后气体总质量不变,容器体积不变,所以密度始终不变,不能据此判断平衡状态,故错误; 故选bc;(2)(i)根据表中数据可知,破坏1molCl2中的化学键所消耗的能量为234KJ,破坏1molBr2中的化学键所消耗的能量为193KJ,破坏1molI2中的化学键所消耗的能量为151KJ,破坏1molH2中的化学键所消耗的能量为436KJ,所以破坏1molH2消耗能量最低,最稳定,H2本身具有的能量最低;故选:A;(ii)根据表中数据可知,破坏1molHCl中的化学键所消耗的能量最高,则说明HCl最稳定,
×0.0025mol/(Ls)=0.0012 5 mol/(Ls),所以答案是:0.0012 5 mol/(Ls);(iii)a.v(NO2)=2v(O2)没有明确反应方向,所以不能据此判断平衡状态,故错误;b.反应前后气体的物质的量减小导致容器内压强减小,当容器内压强保持不变时,各物质的量不变,反应达到平衡状态,故正确;c.v逆(NO)=2v正(O2)=v正(NO),NO正逆反应速率相等,反应达到平衡状态,故正确; d.反应前后气体总质量不变,容器体积不变,所以密度始终不变,不能据此判断平衡状态,故错误; 故选bc;(2)(i)根据表中数据可知,破坏1molCl2中的化学键所消耗的能量为234KJ,破坏1molBr2中的化学键所消耗的能量为193KJ,破坏1molI2中的化学键所消耗的能量为151KJ,破坏1molH2中的化学键所消耗的能量为436KJ,所以破坏1molH2消耗能量最低,最稳定,H2本身具有的能量最低;故选:A;(ii)根据表中数据可知,破坏1molHCl中的化学键所消耗的能量最高,则说明HCl最稳定,
所以答案是:HCl;(iii)根据反应X2+H2═2HX,可以计算新键生成释放的热量均大于旧键断裂吸收的热量,所以X2+H2═2HX的反应是放热反应,
所以答案是:放热反应.
【考点精析】解答此题的关键在于理解化学平衡状态的判断的相关知识,掌握状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等,以及对化学平衡的计算的理解,了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】我国三峡工程所提供的水电,相当于每年燃烧3000万吨原煤的火力发电站产生的电能,因此三峡工程有助于控制
A. 水体污染B. 白色污染C. 酸雨产生D. 农药、化肥污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.钠与水反应:Na+2H2O=Na++2OH﹣+H2↑
B.向次氯酸钙溶液通入少量CO2:Ca2++2ClO﹣+CO2+H2O=CaCO3↓+2HClO
C.实验室用MnO2和浓盐酸制取Cl2:MnO2+4HCl(浓) ![]() ?Mn2++2Cl﹣+Cl2↑+2H2O
?Mn2++2Cl﹣+Cl2↑+2H2O
D.向NH4HCO3溶液中加过量的NaOH溶液:NH4++OH﹣=NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用学过的化学知识解答下列问题:
(1)下列反应中,属于吸热反应的是(填序号). ①煅烧石灰石 ②木炭燃烧 ③炸药爆炸 ④酸碱中和
⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(2)用铜、银与硝酸银设计一个原电池,此电池的正极是 , 负极的电极反应式是 .
(3)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25g,铜表面析出了氢气L(标准状况),导线中通过mol电子.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲醇与苯甲酸是重要的化工原料,可通过苯甲醛在氢氧化钠水溶液中的歧化反应制得,反应式为: 
某研究小组在实验室制备苯甲醇与苯甲酸,反应结束后对反应液按下列步骤处理:
重结晶过程:溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥
已知:苯甲醇易溶于乙醚、乙醇,在水中溶解度较小.
请根据以上信息,回答下列问题:
(1)分离苯甲醇与苯甲酸钠时,合适的萃取剂是 , 简述从分液漏斗中取出上层溶液的方法 . 萃取分液后,所得水层用盐酸酸化的目的是 .
(2)苯甲酸在A,B,C三种溶剂中的溶解度(s)
随温度变化的曲线如图所示:
重结晶时,合适的溶剂是 , 重结晶过程中,趁热过滤的作用是: .
(3)为检验合成产物中苯甲酸的含量,称取试样1.220g,溶解后在容量瓶中定容至100mL,移取25.00mL试样溶液,用0.1000molL﹣1 NaOH溶液滴定,滴定至终点时NaOH溶液共消耗24.50mL,则试样中苯甲酸的含量 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有等体积、等pH的Ba(OH)2、NaOH和NH3H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3 , 则三者的大小关系正确的是( )
A.V3>V2>V1
B.V3=V2=V1
C.V1=V2>V3
D.V3>V2=V1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)键线式 ![]() 表示的分子式;名称是 .
表示的分子式;名称是 .
(2)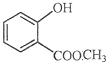 中含有的官能团的名称为 .
中含有的官能团的名称为 .
(3)丁基的4个结构简式为 .
(4)含有杂质的工业乙醇的蒸馏装置中,玻璃仪器有酒精灯、蒸馏瓶、、、尾接管、锥形瓶.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.将等物质的量的X、Y的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下发生可逆反应.下列说法中,正确的是( )
A.达到化学平衡时,正反应速率与逆反应速率不相等
B.反应过程中,Y的单质的体积分数始终为50%
C.达到化学平衡时,X、Y的两种单质在混合气体中的物质的量之比为1:1
D.达到化学平衡的过程中,混合气体平均相对分子质量逐渐减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com