
【题目】A、B、C、D、E、F、G、I均为前四周期原子序数依次增大的元素。A原子的L电子层的p能级上有一个空轨道;C的最外层有6个运动状态不同电子;D的基态原子外围电子排布式为3S2;E与D同周期,且在该周期中电负性最大;F、G是同族且原子序数差2的元素;I的基态原子外围只有一个单电子。
(1) 下列关于A2H4分子和H2C2分子的说法正确的是 。
A.分子中都含有σ键和π键
B.中心原子都sp2杂化
C.都是含极性键和非极性键的非极性分子
D.互为等电子体
E.A2H4分子的沸点明显低于H2C2分子
(2)A、B、C三种元素中的两种,能形成原子个数比为l:3的常见微粒,推测这两种微粒的空间构型为 。
(3)E能形成多种含氧酸,如HEO3、HEO2,请简述酸性HEO3大于HEO2的原因: 。
(4) G与AC能形成挥发性液体G(AC)4,则其固体属于 晶体。
(5) F常见晶体结构为体心立方堆积,原子半径为a nm,I常见晶体结构为面心立方堆积,原子半径为b nm,则两种金属的密度比为 (用含a、b的算式表示)。
【答案】(1)E 1分 (2)平面三角形 1分
(3)HClO3中非羟基氧多,Cl正电性高,导致羟基中O的电子向Cl偏移,在水分子的作用下越易电离出H+,酸性越强。1分(4)分子 1分 (5)7b3/16a3 2分
【解析】试题分析:A原子的L电子层的p能级上有一个空轨道,则A的价电子排布式为2s22p2,为碳元素;C的最外层有6个运动状态不同电子,则C为氧元素,B为氮元素;D的基态原子外围电子排布式为3S2,则D为Mg元素;E与D同周期为第三周期,该周期中电负性最大的为非金属性最强,为氯元素;F、G是同族且原子序数差2的元素,可知为第三周期第Ⅷ族,分别为Fe、Mn元素;I的基态原子外围只有一个单电子,则I应为Cu元素;
(1) A.C2H4分子中含有σ键和π键,但H2O2分子中只有σ键无π键,故A错误;B.C2H4分子中中心原子C原子为sp2杂化,但H2O2分子中O原子为sp3杂化,故B错误;C.都含极性键和非极性键,C2H4分子为非极性分子,H2O2为极性分子,故C错误;D.C2H4分子和H2O2分子原子数目不等,不是等电子体,故D错误;E.H2O2分子间存在氢键,沸点高,C2H4分子的沸点明显低于H2O2分子,故E正确,答案为E。
(2)C、N都能和O形成原子个数比为1:3的常见微粒分别是CO32-、NO3-,中心原子含σ键电子对数为3对,CO32-含有的电子对数=3+![]() =3,NO3-含有的电子对数=3+
=3,NO3-含有的电子对数=3+![]() =3,所以中心原子均为sp2杂化,都是平面三角形结构;
=3,所以中心原子均为sp2杂化,都是平面三角形结构;
(3)Cl能形成多种含氧酸,如HClO3、HClO2,因HClO3中非羟基氧多,Cl正电性高,导致羟基中O的电子向Cl偏移,在水分子的作用下越易电离出H+,酸性越强;
(4) Mn与C、O能形成挥发性液体Mn(CO)4,熔沸点很低,则其属于分子晶体;
(5) Fe常见晶体结构为体心立方堆积,每个晶胞中平均含有2个铁原子,每个晶胞的质量为![]() g,体积为(anm)3;而Cu为面心立方堆积,每个晶胞平均含有4个铜原子,每个晶胞的质量为
g,体积为(anm)3;而Cu为面心立方堆积,每个晶胞平均含有4个铜原子,每个晶胞的质量为![]() g,体积为(bnm)3,则两种金属的密度比为
g,体积为(bnm)3,则两种金属的密度比为![]() =7b3/16a3 。
=7b3/16a3 。


科目:高中化学 来源: 题型:
【题目】有学生在实验室中向盛有10mL饱和氯化铁溶液的试管里投入足量铝片,观察到如下现象:
①黄色溶液很快变成红褐色,过一会儿溶液中有红褐色沉淀生成。
②铝片表面立刻有少量黑色物质析出,黑色物质能被磁铁吸起。
③混合液温度升高甚至发烫,产生无色气泡,且产生气泡速率明显加快,铝片上下翻滚。
(1)产生的红褐色沉淀是______________,无色气泡的成分是___________。
(2)生成红褐色沉淀的原因是_____________________________。
(3)写出生成气泡速率明显加快的两个原因____________、_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反-2-己烯醛(D)是一种重要的合成香料,下列合成路线是制备D的方法之一。根据该合成路线回答下列问题:
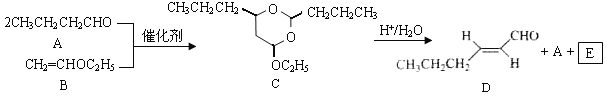
已知: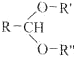
![]() RCHO+R'OH+R"OH
RCHO+R'OH+R"OH
(1)A的名称是__________;B分子中共面原子数目最多为__________;C分子中与环相连的三个基团中,不同化学环境的氢原子共有__________种。
(2)D中含氧官能团的名称是__________,写出检验该官能团的化学反应方程式__________。
(3)E为有机物,能发生的反应有__________
a.聚合反应 b.加成反应 c.消去反应 d.取代反应
(4)B的同分异构体F与B有完全相同的官能团,写出F所有可能的结构________。
(5)以D为主要原料制备己醛(目标化合物),在方框中将合成路线的后半部分补充完整。
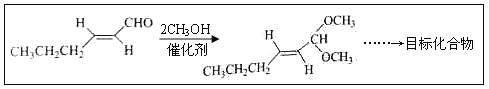
(6)问题(5)的合成路线中第一步反应的目的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烷和丙烷的混合气体完全燃烧后,先将产物通过浓硫酸,充分吸收后浓硫酸增重3.06g;然后通过过氧化钠固体,充分反应后固体增重3.36g.混合气体中乙烷和丙烷的体积比为( )
A.1:1 B.2:3 C.3:2 D.3:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸(无色针状晶体,熔点122.4℃)可广泛用于医药、染料载体、香料等,实验室用甲苯和高锰酸钾制备苯甲酸。反应方程式如下:
![]() +2KMnO4
+2KMnO4![]()
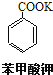 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
![]() +HCl→
+HCl→![]() +KCl
+KCl
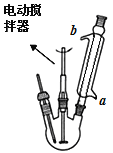
已知有关化合物的相关数据如表所示:
化合物 | 相对分子质量 | 密度(g/cm3) | 溶解性 | 沸点(℃) |
甲苯 | 92 | 0.87 | 难溶于水 | 110.0 |
苯甲酸钾 | 160 | — | 易溶于水 | — |
苯甲酸 | 122 | 1.26 | 微溶于水 | 248.0 |
苯甲酸在100g水中的溶解度0.18g(4℃),0.27g(18℃),2.2g(75℃)。
合成:如上图(固定及加热装置略去)所示,在三颈烧瓶中加入4.23mL甲苯和100mL蒸馏水,瓶口装上温度计、电动搅拌器、冷凝管,慢慢开启电动搅拌器,加热至沸腾。经冷凝管上口分批加入21.30g高锰酸钾(过量),继续煮沸至甲苯层消失,回流液中不再出现油珠为止,得到反应混合物。
对反应混合物进行分离:①趁热过滤→②洗涤滤渣→③合并滤液和洗涤液→④冷却→⑤盐酸酸化→⑥过滤。
对粗产品苯甲酸进行提纯:①沸水溶解→②活性炭脱色→③趁热过滤→④_________→⑤过滤→⑥洗涤→⑦干燥。
请回答下列问题:
(1)实验室中量取4.23mL甲苯所需仪器为_________。
(2)冷凝管的上口是否需要塞上塞子________(填“是”或“否”),a处水流方向是_______(填“进水”或“出水”)。
(3)高锰酸钾需要分批加入,请用化学反应速率观点说明理由_________。
(4)在对粗产品苯甲酸进行提纯过程中,“③趁热过滤”的目的是_________;“④”的操作名称是________;可证明“⑥洗涤”步骤已洗涤干净的方法是_____________。
(5)干燥后称量得苯甲酸2.93g,则苯甲酸的产率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
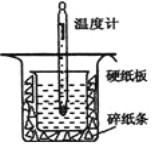
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是_________,除此之外,装置中的一个明显错误是 。
(2)若改用60mL 0.25mol·L-1 H2SO4和50mL 0.55mol·L-1NaOH溶液进行反应与上述实验相比,所放出的热量________ ___(填“相等”、“不相等”),若实验操作均正确,则所求中和热________ ___(填“相等”“不相等”)。
(3)实验数据如下表:
①请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 |
|
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=______ ____ ( 取小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数,下列叙述错误的是
A.1molC10H22分子中共价键总数为31NA个
B.0.1molCH4中含有NA个电子
C.标准状况下,22.4LCHCl3含有氯原子数目为3NA个
D.标准状况下,22.4L甲烷和乙烷混合气体中的分子数NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在原电池和电解池的电极上所发生的反应,同属还原反应的是 ( )
A.原电池正极和电解池阳极所发生的反应
B.原电池正极和电解池阴极所发生的反应
C.原电池负极和电解池阳极所发生的反应
D.原电池负极和电解池阴极所发生的反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com