
【题目】NA为阿伏伽德罗常数,下列叙述错误的是
A.1molC10H22分子中共价键总数为31NA个
B.0.1molCH4中含有NA个电子
C.标准状况下,22.4LCHCl3含有氯原子数目为3NA个
D.标准状况下,22.4L甲烷和乙烷混合气体中的分子数NA个
科目:高中化学 来源: 题型:
【题目】工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法正确的是
选项 | 污染物 | 处理措施 | 方法类别 |
A | 废酸 | 加生石灰中和 | 物理法 |
B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
C | 含苯废水 | 用活性炭吸附 | 物理法 |
D | 含纯碱的废水 | 加石灰水反应 | 化学法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G、I均为前四周期原子序数依次增大的元素。A原子的L电子层的p能级上有一个空轨道;C的最外层有6个运动状态不同电子;D的基态原子外围电子排布式为3S2;E与D同周期,且在该周期中电负性最大;F、G是同族且原子序数差2的元素;I的基态原子外围只有一个单电子。
(1) 下列关于A2H4分子和H2C2分子的说法正确的是 。
A.分子中都含有σ键和π键
B.中心原子都sp2杂化
C.都是含极性键和非极性键的非极性分子
D.互为等电子体
E.A2H4分子的沸点明显低于H2C2分子
(2)A、B、C三种元素中的两种,能形成原子个数比为l:3的常见微粒,推测这两种微粒的空间构型为 。
(3)E能形成多种含氧酸,如HEO3、HEO2,请简述酸性HEO3大于HEO2的原因: 。
(4) G与AC能形成挥发性液体G(AC)4,则其固体属于 晶体。
(5) F常见晶体结构为体心立方堆积,原子半径为a nm,I常见晶体结构为面心立方堆积,原子半径为b nm,则两种金属的密度比为 (用含a、b的算式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(i)现有下列5种有机物:
①CH≡CH ②CH3CH2OH ③![]()
④![]() ⑤
⑤![]() ⑥ HOCH2CH2CH2COOH
⑥ HOCH2CH2CH2COOH
(1) 其中,属于烃的衍生物是 _____________(填序号,下同);
(2) 因反应使溴的四氯化碳溶液褪色的是_____________;
(3) 所有原子在同一条线上的是_____________;
(4) ⑥能自身发生反应生成五元环化合物,该反应的反应类型是____________。
(ii)酯化反应是重要的有机化学反应之一。甲同学为了研究该反应机理使用了 “CH3CH218OH”和乙酸做该实验,结果含18O原子的产物的结构简式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙烯为原料合成化合物C的流程如图所示:
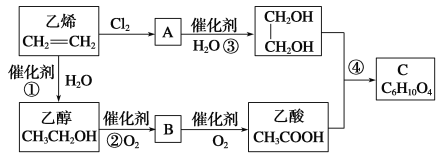
(1)写出A的结构简式:________________
(2)乙酸分子中的官能团名称是_________,写出1种可鉴别乙醇和乙酸的化学试剂: _____________________。(2分)
(3)写出反应①、②、④的化学方程式并指出反应类型
①_____________________________________________;_____________;
②_____________________________________________;_____________;
④_____________________________________________;_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCN超标的电镀废水可用两段氧化法处理:
(1)NaCN与NaClO反应,生成NaOCN和NaCl
(2)NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×10-10)有剧毒;HCN、HOCN中N元素的化合价相同。
完成下列填空:
(5)上述反应涉及到的元素中,氯原子核外电子能量最高的电子亚层是___________;H、C、N、O、Na的原子半径从小到大的顺序为_______。
(6)HCN是直线型分子,HCN是___________分子(选填“极性”或“非极性”)。HClO的电子式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选修2 :化学与技术】
某工厂的镀铜废水中含有CN-和Cr2O72一离子,需要处理达标后才能排放。该厂拟用下列流程进行废水处理,回答下列问题:
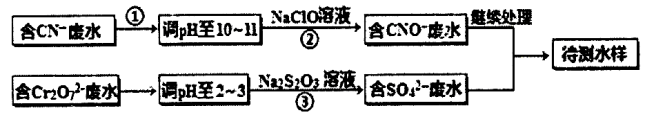
(1)流程中可用pH 试纸测定溶液的pH,pH试纸的使用方法是_______;
(2)步骤②中反应无气体放出,该反应的离子方程式为____;
(3)步骤③中,每处理1.0molCr2O7—时转移电子数为6NA,该反应的离子方程式为_____;
(4)取少量待测水样于试管中,加入NaOH 溶液,观察到有蓝色沉淀生成,再加Na2S溶液,蓝色沉淀转化成黑色沉淀,产生该现象对应的离子方程式为_________。
(5)含氰化物的废水必须经检测达标后(排放标准为CN—的含量<0.5mg/L)才能排放。现取该法处理 后的废水100.0mL,用“试银灵”为指示剂、1.0×10-4mol/L的AgNO3标准溶液滴定,终点时溶液由黄色变为橙红色,消耗标准液的体积为5.00mL,反应的离子方程式为Ag + 2CN—=[Ag(CN)2]一,该水样中CN-的含量为________mg/L(不考虑Cr等元素的干扰)。该厂处理后的废水能否合法排放________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示:
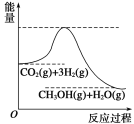
(1)你认为该反应为____________(填放热或吸热)反应.
(2)恒容容器中,对于以上反应,能加快反应速率的是 。
a.升高温度 b.充入He c.加入催化剂 d.降低压强
(3)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。
t/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
从反应开始到5min末,用H2浓度变化表示的平均反应速率v(H2)= ;反应达到平衡状态,此时H2的转化率为 。
(4)在相同温度、容积不变的条件下,能说明该反应已达平衡状态的是 (填序号)。
a.CO2、H2、CH3OH、H2O的浓度均不再变化
b.v生成(CH3OH)=v消耗(CO2)
c.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶1∶1∶1
d.容器中混合气体的密度保持不变
e. H2的消耗速率与CH3OH的消耗速率之比为3∶1
f.体系压强不变
(5)以CH3OH、空气、氢氧化钾溶液为原料,石墨为电极可构成然料电池,该电池中负极上的电极反应式是:_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com