
【题目】【选修2 :化学与技术】
某工厂的镀铜废水中含有CN-和Cr2O72一离子,需要处理达标后才能排放。该厂拟用下列流程进行废水处理,回答下列问题:
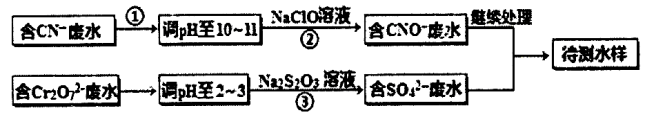
(1)流程中可用pH 试纸测定溶液的pH,pH试纸的使用方法是_______;
(2)步骤②中反应无气体放出,该反应的离子方程式为____;
(3)步骤③中,每处理1.0molCr2O7—时转移电子数为6NA,该反应的离子方程式为_____;
(4)取少量待测水样于试管中,加入NaOH 溶液,观察到有蓝色沉淀生成,再加Na2S溶液,蓝色沉淀转化成黑色沉淀,产生该现象对应的离子方程式为_________。
(5)含氰化物的废水必须经检测达标后(排放标准为CN—的含量<0.5mg/L)才能排放。现取该法处理 后的废水100.0mL,用“试银灵”为指示剂、1.0×10-4mol/L的AgNO3标准溶液滴定,终点时溶液由黄色变为橙红色,消耗标准液的体积为5.00mL,反应的离子方程式为Ag + 2CN—=[Ag(CN)2]一,该水样中CN-的含量为________mg/L(不考虑Cr等元素的干扰)。该厂处理后的废水能否合法排放________。
【答案】(1)用镊子夹取一小块试纸放在洁净的玻璃片或表面皿上,用玻璃棒蘸取待测溶液点在试纸的中央,变色后与标准比色卡对照,即可确定溶液的pH (其他合理答案亦可)( 2分)
(2)CN-+ClO-=CNO-+Cl-(3分)
(3)3S2O32-+4Cr2O72-+26H+=6SO42-+Cr3++13H2O(3分)
(4)Cu2++2OH=Cu(OH)2↓ Cu(OH)2(S)+S2- (aq)=CuS(s)+2OH-(aq)(各2分)
(5)0.26(2分)能(1分)
【解析】
试题分析:(1)用PH试纸测定溶液PH的方法:用镊子夹取一小块试纸放在洁净的玻璃片或表面皿上,用玻璃棒蘸取待测溶液点在试纸的中央,变色后与标准比色卡对照,即可确定溶液的pH 。(2)CN- 具有很强的还原性,ClO- 具有很强的氧化性,故该氧化还原反应的离子方程式为CN-+ClO-=CNO-+Cl-。(3)3S2O32-+4Cr2O72-+26H+=6SO42-+Cr3++13H2O(4)该待测水样为镀铜废水,而Cu(OH)2是高中阶段需要掌握的唯一一种蓝色沉淀,且KSP(CuS)<KSP(Cu(OH)2),所以产生现象的对应的离子方程式是:Cu2++2OH=Cu(OH)2↓ Cu(OH)2(S)+S2- (aq)=CuS(s)+2OH-(aq)。(5)nAg+=5×10-7mol,所以nCN-=1×10-6,mol=2.6×10-2mg,故C(CN-)=0.26mg/L,达到标准所以可以排放。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】乙烷和丙烷的混合气体完全燃烧后,先将产物通过浓硫酸,充分吸收后浓硫酸增重3.06g;然后通过过氧化钠固体,充分反应后固体增重3.36g.混合气体中乙烷和丙烷的体积比为( )
A.1:1 B.2:3 C.3:2 D.3:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数,下列叙述错误的是
A.1molC10H22分子中共价键总数为31NA个
B.0.1molCH4中含有NA个电子
C.标准状况下,22.4LCHCl3含有氯原子数目为3NA个
D.标准状况下,22.4L甲烷和乙烷混合气体中的分子数NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列每组中各有三对物质,它们都能用分液漏斗分离的是
A.乙酸乙酯和水,乙醇和水,己烯和水
B.二溴乙烷和水,溴苯和水,硝基苯和水
C.己烷和水,乙醛和水,乙酸和乙醇
D.乙酸和水,甲苯和水,己烷和己烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列物质按酸、碱、盐分类依次排列正确的是
A. 硫酸、纯碱、石灰石 B. 氢硫酸、烧碱、绿矾
C. 石炭酸、熟石膏、醋酸钠 D. 磷酸、乙醇钠、苛性钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿是工业上制取铝的基本原料.为了除去铝土矿中的少量Fe2O3和SiO2等杂质制得纯净的Al2O3,化学兴趣小组设计探究实验,操作过程如图所示:
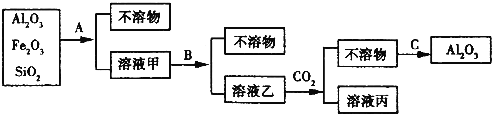
(1)操作过程中的试剂或方法:A加入的试剂______,B加入的试剂______,C采用的方法______。
(2)在溶液乙中通入过量CO2后发生反应的离子方程式为_______________。
(3)如果A、B互换,则通C02应改加______。
(4)如果A、B互换,将溶液乙蒸干并灼烧,所得固体产物的主要成分是______(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在原电池和电解池的电极上所发生的反应,同属还原反应的是 ( )
A.原电池正极和电解池阳极所发生的反应
B.原电池正极和电解池阴极所发生的反应
C.原电池负极和电解池阳极所发生的反应
D.原电池负极和电解池阴极所发生的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析生产生活中的下列过程,不涉及氧化还原反应的是( )
A.煤液化制得清洁能源 B.人工固氮
C.将氯气通入冷的消石灰中制漂白粉 D.从海水中提取氯化镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年12月17日,中国国土资源部召开新闻发布会,宣布在广东沿海珠江口盆地东部海域首次钻获高纯度可燃冰。可燃冰的主要成分是甲烷,甲烷既是清洁的燃料,也是重要的化工原料。
(1)甲烷和二氧化碳重整制合成气,对于温室气体的治理具有重大意义。
已知:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)ΔH=+247.3 kJ·mol-1
2CO(g)+2H2(g)ΔH=+247.3 kJ·mol-1
CH4(g)![]() C(s)+ 2H2(g) ΔH=+75 kJ·mol-1
C(s)+ 2H2(g) ΔH=+75 kJ·mol-1
①反应2CO(g)![]() C(s)+CO2(g)在一定条件下能自发进行的原因是 。
C(s)+CO2(g)在一定条件下能自发进行的原因是 。
②合成甲醇的主要反应是:2H2(g)+CO(g)![]() CH3OH(g)ΔH=-90.8 kJ·mol-1,T ℃下此反应的平衡常数为160。某时刻测得各组分的浓度如下:
CH3OH(g)ΔH=-90.8 kJ·mol-1,T ℃下此反应的平衡常数为160。某时刻测得各组分的浓度如下:
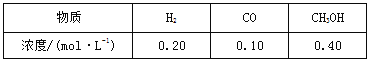
比较此时正、逆反应速率的大小:v(正) v(逆)(填“>”、“<”或“=”)。生产过程中,合成气要进行循环,其目的是 。
③在一恒容密闭容器中,要提高反应2H2(g)+CO(g)![]() CH3OH(g)中CO的转化率,可以采取的措施是 。
CH3OH(g)中CO的转化率,可以采取的措施是 。
a.升温
b.加入催化剂
c.增加CO的浓度
d.加入H2
e.加入惰性气体
f.分离出甲醇
(2)以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。
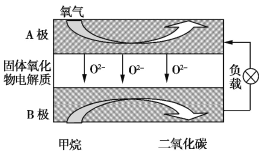
①B极为电池 极,电极反应式为 。
②若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗甲烷的体积为 (标况下)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com