
【题目】铝土矿是工业上制取铝的基本原料.为了除去铝土矿中的少量Fe2O3和SiO2等杂质制得纯净的Al2O3,化学兴趣小组设计探究实验,操作过程如图所示:
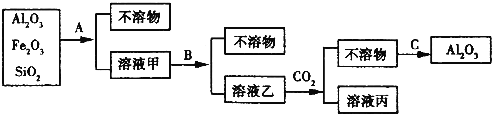
(1)操作过程中的试剂或方法:A加入的试剂______,B加入的试剂______,C采用的方法______。
(2)在溶液乙中通入过量CO2后发生反应的离子方程式为_______________。
(3)如果A、B互换,则通C02应改加______。
(4)如果A、B互换,将溶液乙蒸干并灼烧,所得固体产物的主要成分是______(写化学式)。
【答案】(1)盐酸;氢氧化钠;加热 (2)AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓
(3)氨水 (4)Al2O3、NaCl
【解析】
试题分析:氧化铝是两性氧化物,既溶液强酸又溶于强碱。Fe2O3溶于强酸,不溶于碱,SiO2只溶于强碱,不溶于酸。由工艺流程可知,溶液乙中通入二氧化碳得到不溶物,不溶物可以得到氧化铝,故溶液乙中含有偏铝酸根,则A应为盐酸,过滤得到不溶为SiO2,溶液甲中含有铝离子、铁离子,再加入氢氧化钠溶液,除去铁离子,不溶物为氢氧化铁,将铝离子转化为偏铝酸根,过滤偏铝酸根进入溶液乙中,在溶液中与二氧化碳反应生成Al(OH)3,加热生成Al2O3,
(1)由上述分析可知,A为盐酸、过滤,B为氢氧化钠、过滤,C为加热;
(2)偏铝酸钠溶液与过量二氧化碳反应生成氢氧化铝沉淀与碳酸氢钠,反应离子方程式为:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓;
(3)若将A、B互换,溶液甲中含有偏铝酸根离子、硅酸根离子,再加入盐酸,溶液乙中主要含有铝离子、氯离子、钠离子,应加入氨水将铝离子转化氢氧化铝沉淀;
(4)若将A、B互换,溶液乙中主要含有铝离子、氯离子、钠离子,加热溶液乙,HCl挥发、铝离子水解,得到Al(OH)3及NaCl,灼烧Al(OH)3分解生成Al2O3,故所得固体产物的主要成分是Al2O3、NaCl。


科目:高中化学 来源: 题型:
【题目】以乙烯为原料合成化合物C的流程如图所示:
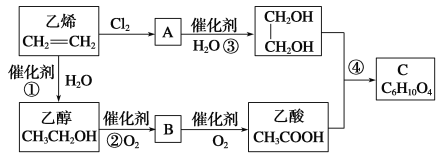
(1)写出A的结构简式:________________
(2)乙酸分子中的官能团名称是_________,写出1种可鉴别乙醇和乙酸的化学试剂: _____________________。(2分)
(3)写出反应①、②、④的化学方程式并指出反应类型
①_____________________________________________;_____________;
②_____________________________________________;_____________;
④_____________________________________________;_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究化学反应中的能量变化,某同学设计了如下两个实验。

(1)图Ⅰ中发生反应的化学方程式为 ,实验中温度计指示的温度变化及其原因是 。
(2)图Ⅱ实验的实验现象如下表,请完成相应实验现象的解释。
实验现象 | 解释原因 |
Cu片上产生了大量气泡 | |
温度计指示的温度无明显变化 |
(3)若将图中的Cu片替换为Fe片,则Fe片上的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选修2 :化学与技术】
某工厂的镀铜废水中含有CN-和Cr2O72一离子,需要处理达标后才能排放。该厂拟用下列流程进行废水处理,回答下列问题:
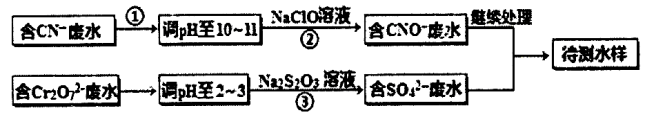
(1)流程中可用pH 试纸测定溶液的pH,pH试纸的使用方法是_______;
(2)步骤②中反应无气体放出,该反应的离子方程式为____;
(3)步骤③中,每处理1.0molCr2O7—时转移电子数为6NA,该反应的离子方程式为_____;
(4)取少量待测水样于试管中,加入NaOH 溶液,观察到有蓝色沉淀生成,再加Na2S溶液,蓝色沉淀转化成黑色沉淀,产生该现象对应的离子方程式为_________。
(5)含氰化物的废水必须经检测达标后(排放标准为CN—的含量<0.5mg/L)才能排放。现取该法处理 后的废水100.0mL,用“试银灵”为指示剂、1.0×10-4mol/L的AgNO3标准溶液滴定,终点时溶液由黄色变为橙红色,消耗标准液的体积为5.00mL,反应的离子方程式为Ag + 2CN—=[Ag(CN)2]一,该水样中CN-的含量为________mg/L(不考虑Cr等元素的干扰)。该厂处理后的废水能否合法排放________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素是典型的非金属元素,其单质及其化合物具有广泛的用途。已知:KMnO4与浓盐酸常温下反应可生成氯气。根据所学化学知识及所给信息,回答下列有关问题:

(1)下列可以用来判断氯、溴、碘元素非金属性强弱的是 (填序号)。
①HCl、HBr、HI的热稳定性逐渐减弱;
②AgCl、AgBr、AgI的颜色逐渐加深;
③ HCl、HBr、HI的酸性依次减弱;
④ Cl2、Br2、I2的颜色逐渐加深;
⑤ Cl2、Br2、I2和H2反应条件由光照(或点燃)→ 一定温度→ 持续加热;条件由易到难;
⑥Cl2、Br2、I2的氧化性逐渐减弱。
(2)某化学探究小组选用右图所示的装置和下列所给的试剂来证明非金属性:Cl>I,请你按照他们的设计思路完成该实验。
可供选择的试剂有:①浓盐酸,②硝酸银溶液,③KMnO4,④稀盐酸,⑤淀粉碘化钾溶液, ⑥MnO2, ⑦NaOH溶液;⑧浓硫酸
烧瓶A中应盛放的药品是 (填序号),试管C中应盛放的药品是 (填序号),则装置D的作用是 。观察到 现象,即可证明非金属性Cl>I。
(3)一定条件,在水溶液中1 mol Cl-、ClOX-(x=1,2,3,4)的能量(KJ)相对大小如图所示。

①D是 (填离子符号)。
②B→A+C反应的离子方程式为 ;生成1molC时, KJ的热(填吸收或放出以及具体数值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是学习物质结构与性质的重要工具。下表是元素周期表的一部分,表中所列字母a、b、c、d、e、f、g、m、n、o、r分别代表某一种元素。请回答下列问题。
a | |||||||||||||||||
c | b | n | |||||||||||||||
d | e | o | f | ||||||||||||||
m | r | g | |||||||||||||||
(1)g元素的原子序数为 ;上述所给11种元素中非金属元素共有 种。
(2)m元素在元素周期表中的位置 ;e、n二元素形成的稳定化合物的化学式为 。
(3)o元素离子的电子式为 ;化合物ba3的结构式为 。
(4)用电子式表示化合物d2n的形成过程 ;
(5)d的最高价氧化物的水化物与e的最高价氧化物反应的离子方程式 。
(6)单质r与b的最高价氧化物的水化物的稀溶液反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照表中所示方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是 。
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为 。
(3)实验①和②的目的是 。
实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2 稳定,不易分解。为了达到实验目的,你对原实验方案的改进是 。
(4)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。

分析图像能够得出的实验结论是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com