
【题目】为了探究化学反应中的能量变化,某同学设计了如下两个实验。

(1)图Ⅰ中发生反应的化学方程式为 ,实验中温度计指示的温度变化及其原因是 。
(2)图Ⅱ实验的实验现象如下表,请完成相应实验现象的解释。
实验现象 | 解释原因 |
Cu片上产生了大量气泡 | |
温度计指示的温度无明显变化 |
(3)若将图中的Cu片替换为Fe片,则Fe片上的电极反应式为 。
【答案】(1)Zn+H2SO4=ZnSO4+H2↑;升高;锌与稀硫酸反应是放热反应
(2)Zn、Cu构成原电池,H+在Cu片上得电子产生氢气;反应中的化学能主要转化成了电能。
(3)2H++2e-=H2↑
【解析】
试题分析:(1)图Ⅰ中发生反应为活泼金属与酸的置换反应,该的化学方程式为:Zn+H2SO4=ZnSO4+H2↑;实验中温度计指示的温度升高,原因是锌与稀硫酸反应是放热反应。
故答案为:Zn+H2SO4=ZnSO4+H2↑;升高;锌与稀硫酸反应是放热反应。
(2)图Ⅱ所示为铜锌原电池实验装置,活泼金属锌做负极,发生氧化反应逐渐溶解;铜为正极,发生还原反应H+在Cu片上得电子产生氢气;由于该反应中化学能主要转化为电能,所以溶液温度无明显变化。
故答案为:Zn、Cu构成原电池,H+在Cu片上得电子产生氢气;反应中的化学能主要转化成了电能;
(3)若将图中的Cu片替换为Fe片,则铁为正极,Fe片上的电极反应式为:2H++2e-=H2↑。
故答案为:2H++2e-=H2↑。


科目:高中化学 来源: 题型:
【题目】2011年10月23日,土耳其因发生7.2级地震而使当地的饮用水受污染.医疗救助人员打算给当地居民提供一些关于饮用水处理的建议,下列建议不合理的是
A.用明矾使悬浮颗粒沉降下来
B.用漂白粉进行消毒杀菌
C.只要无色透明,就可以放心饮用
D.饮用前加热煮沸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2014年中国十大科技成果之一是:我国科学家成功实现甲烷在催化剂及无氧条件下,一步高效生产乙烯、芳烃和氢气等化学品,为天然气化工开发了一条革命性技术。以甲烷为原料合成部分化工产品流程如下(部分反应条件已略去):
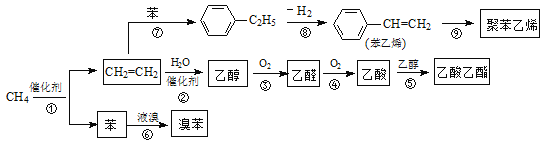
(1)乙烯分子中所含官能团名称为 ;乙酸分子中所含官能团名称为 。
(2)聚苯乙烯的结构简式为 。
(3)图中9步反应中只有两步属于取代反应,它们是 (填序号)。
(4)写出下列反应的化学方程式(注明反应条件):反应③为 ;反应⑤为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列每组中各有三对物质,它们都能用分液漏斗分离的是
A.乙酸乙酯和水,乙醇和水,己烯和水
B.二溴乙烷和水,溴苯和水,硝基苯和水
C.己烷和水,乙醛和水,乙酸和乙醇
D.乙酸和水,甲苯和水,己烷和己烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁合金已成为飞机制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某含镁3%-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
【方案一】(1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0mol/L NaOH溶液中,使其反应完全,过滤、洗涤、干燥、称量固体。实验中发生反应的化学方程式是__________.该步骤中若未洗涤固体,测得镁的质量分数将______(填“偏高”、“偏低”或“无影响”)。
【方案二】
将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01×105Pa)的体积.
(1)同学们拟选用下列实验装置完成实验如图1:
①你认为最简易的装置其连接顺序是:A接______接______接______(填接口字母,可不填满.)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶.请你帮助分析原因______.
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是______。
A、待实验装置冷却后再读数
B、上下移动量筒F,使其中液面与广口瓶中液面相平
C、上下移动量筒G,使其中液面与广口瓶中液面相平
D、视线与凹液面的最低点水平读取量筒中水的体积
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小.于是他们设计了图2所示的实验装置。
①装置中导管a的作用是______。
②怎样检查图2装置的气密性____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿是工业上制取铝的基本原料.为了除去铝土矿中的少量Fe2O3和SiO2等杂质制得纯净的Al2O3,化学兴趣小组设计探究实验,操作过程如图所示:
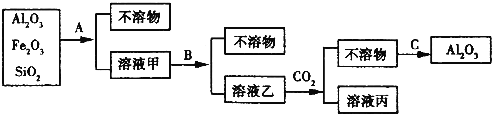
(1)操作过程中的试剂或方法:A加入的试剂______,B加入的试剂______,C采用的方法______。
(2)在溶液乙中通入过量CO2后发生反应的离子方程式为_______________。
(3)如果A、B互换,则通C02应改加______。
(4)如果A、B互换,将溶液乙蒸干并灼烧,所得固体产物的主要成分是______(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.垃圾资源化的主要途径是卫生填埋
B.人类的活动不影响氮、硫元素在自然界的循环
C.推广使用新能源,可以减少二氧化碳等温室气体的排放
D.在日常生活中,化学腐蚀是造成钢铁腐蚀的主要原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理在科研和工农业生产中有广泛应用。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0。在1 L 密闭容器中加入0.1 mol N2和0.3 mol H2,实验①、②、③中c(N2)随时间(t)的变化如图所示:
2NH3(g) ΔH<0。在1 L 密闭容器中加入0.1 mol N2和0.3 mol H2,实验①、②、③中c(N2)随时间(t)的变化如图所示:
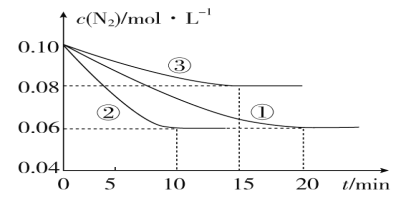
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=____________;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的________、________(填字母编号)。
a.增大压强 b.减小压强
c.升高温度 d.降低温度
e.使用催化剂
(2)800 K时向下列起始体积相同的密闭容器中充入2 mol N2、3 mol H2,甲容器在反应过程中保持温度压强不变,乙容器保持温度体积不变,丙容器是绝热容器保持体积不变,三容器各自建立化学平衡。
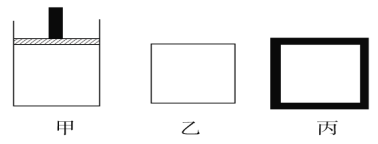
①达到平衡时,平衡常数K甲________K乙________K丙(填“>”“<”或“=”)。
②达到平衡时N2的浓度c(N2)甲________c(N2)乙,c(N2)乙________c(N2)丙(填“>”“<”或“=”)。
③对甲、乙、丙三容器的描述,以下说法正确的是____________。
A.甲容器气体密度不再变化时,说明此反应已达到平衡状态
B.在乙中充入稀有气体He,化学反应速率加快
C.丙容器温度不再变化时说明已达平衡状态
D.向丙容器中充入氨气,正向速率减小,逆向速率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com