
【题目】化学反应原理在科研和工农业生产中有广泛应用。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0。在1 L 密闭容器中加入0.1 mol N2和0.3 mol H2,实验①、②、③中c(N2)随时间(t)的变化如图所示:
2NH3(g) ΔH<0。在1 L 密闭容器中加入0.1 mol N2和0.3 mol H2,实验①、②、③中c(N2)随时间(t)的变化如图所示:
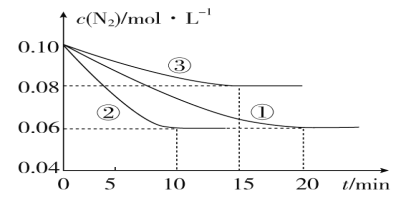
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=____________;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的________、________(填字母编号)。
a.增大压强 b.减小压强
c.升高温度 d.降低温度
e.使用催化剂
(2)800 K时向下列起始体积相同的密闭容器中充入2 mol N2、3 mol H2,甲容器在反应过程中保持温度压强不变,乙容器保持温度体积不变,丙容器是绝热容器保持体积不变,三容器各自建立化学平衡。
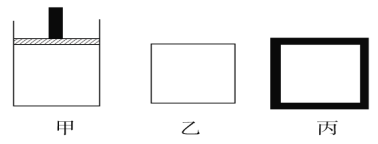
①达到平衡时,平衡常数K甲________K乙________K丙(填“>”“<”或“=”)。
②达到平衡时N2的浓度c(N2)甲________c(N2)乙,c(N2)乙________c(N2)丙(填“>”“<”或“=”)。
③对甲、乙、丙三容器的描述,以下说法正确的是____________。
A.甲容器气体密度不再变化时,说明此反应已达到平衡状态
B.在乙中充入稀有气体He,化学反应速率加快
C.丙容器温度不再变化时说明已达平衡状态
D.向丙容器中充入氨气,正向速率减小,逆向速率增大
【答案】(1)0.008 mol·L-1·min-1;e、b
(2)①=;>
②>;<
③A C
【解析】
试题分析:(1)根据像可知,②在10min时达到平衡,此时氮气的浓度变化为0.04mol/L,根据方程式或知,氨气的浓度变化了0.08mol/L,根据v= ![]() 可知v(NH3)=
可知v(NH3)=![]() =0.008molL-1min-1,根据图象可知②到达平衡的时间比①短,到达平衡时N2的浓度与①相同,化学平衡不移动,故②与①相比加了催化剂,故选e,①和③比较可知,③的速率比①小,平衡时氮气的浓度高,即平衡逆向移动,故③升减小了压强,故选b,
=0.008molL-1min-1,根据图象可知②到达平衡的时间比①短,到达平衡时N2的浓度与①相同,化学平衡不移动,故②与①相比加了催化剂,故选e,①和③比较可知,③的速率比①小,平衡时氮气的浓度高,即平衡逆向移动,故③升减小了压强,故选b,
故答案为:0.008molL-1min-1;e、b;
(2)①甲乙容器温度不变,平衡常数不变,丙容器绝热,温度升高平衡逆向进行,平衡常数减小,故K甲=K乙>K丙。
故答案为:=,>;
②甲容器在反应过程中保持压强不变,故容器体积减小,氮气的浓度增大;乙容器保持体积不变,随着反应的进行,压强减小;丙容器绝热,温度升高平衡逆向进行,故达到平衡时N2的浓度c(N2)甲>c(N2)乙<c(N2)丙。
故答案为:>,<;
③A.密度=m/V,总质量一定,甲容器为恒压装置,当气体密度不再变化时,说明气体总量不再发生变化,此反应已达到平衡状态,故A正确。B.乙为恒容装置,在乙中充入稀有气体He,反应物浓度不变,化学反应速率不变,故B错误;C.丙容器绝热,故丙容器温度不再变化时说明已达平衡状态,故C正确; D.向丙容器中充入氨气,正、逆反应速率均增大,故D错误。
故答案为:AC。


科目:高中化学 来源: 题型:
【题目】为了探究化学反应中的能量变化,某同学设计了如下两个实验。

(1)图Ⅰ中发生反应的化学方程式为 ,实验中温度计指示的温度变化及其原因是 。
(2)图Ⅱ实验的实验现象如下表,请完成相应实验现象的解释。
实验现象 | 解释原因 |
Cu片上产生了大量气泡 | |
温度计指示的温度无明显变化 |
(3)若将图中的Cu片替换为Fe片,则Fe片上的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:① N2(g) + O2(g) ![]() 2NO(g) △H1=+180.5 kJ·mol-1
2NO(g) △H1=+180.5 kJ·mol-1
② C和CO的燃烧热(△H)分别为-393.5 kJ·mol-1和-283 kJ·mol-1
则2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g)的△H=_____kJ·mol-1
N2(g) + 2CO2(g)的△H=_____kJ·mol-1
(2)将0.20 mol NO和0.10 mol CO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。
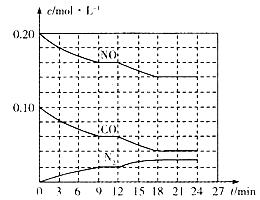
①CO在0-9min内的平均反应速率v(CO)=________mol·L-1·min-1(保留两位有效数字);第12 min时改变的反应条件可能为________。
A.升高温度 B.加入NO C.加催化剂 D.降低温度
②该反应在第24 min时达到平衡状态,CO2的体积分数为________(保留三位有效数字),化学平衡常数值为________(保留两位有效数字)。
(3)烟气中的SO2可用某浓度NaOH溶液吸收,若将一定量的SO2气体通入到300mL NaOH的溶液中,再在所得溶液中逐滴加入稀盐酸至过量,产生的气体与反应的HCl两者物质的量的关系如图所示(气体的溶解和HCl的挥发忽略,NaHSO3水溶液为酸性):
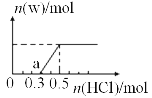
①O点溶液中所含溶质的化学式为_________________;
②a点溶液中各离子溶度大小关系为______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物;Y与氧元素可组成Y2O和Y2O2的离子化合物。
(1)写出Y2O2的电子式:____ _,其中含有的化学键是___ _。
(2)用电子式表示Y2O的形成过程________ _______。
(3)X、Z、W三种元素的最高价氧化物对应的水化物中,稀溶浓氧化性最强的是_____(填化学式)。
(4)XH3、H2Z和HW三种化合物,其中一种与另外两种都能反应的是__________(填化学式)。
(5)由X、Y组成的化合物分子中.X、W原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式_______________ ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )

A.反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol 电子
3H2+CO,每消耗1molCH4转移12mol 电子
B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C.电池工作时,CO32-向电极B移动
D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照表中所示方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是 。
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为 。
(3)实验①和②的目的是 。
实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2 稳定,不易分解。为了达到实验目的,你对原实验方案的改进是 。
(4)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。

分析图像能够得出的实验结论是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1 mol·L-1NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
(2)下列操作中,容量瓶所不具备的功能有________(填序号)。

A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为______g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度________0.1 mol·L-1(填“大于”“等于”或“小于”,下同)。若NaOH溶液在转移至容量瓶时未经冷却,则所得溶液浓度________0.1 mol·L-1。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数)。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A.Fe2(SO4)3易溶于水,可用作净水剂
B.Al2O3熔点高,可用作耐高温材料
C.铁比铜金属性强,可用FeCl3腐蚀Cu刻制印刷电路板
D.NaHCO3溶于水呈碱性,可作抗酸药,服用时喝些醋能提高药效
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com