
【题目】目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示:
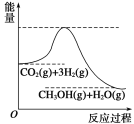
(1)你认为该反应为____________(填放热或吸热)反应.
(2)恒容容器中,对于以上反应,能加快反应速率的是 。
a.升高温度 b.充入He c.加入催化剂 d.降低压强
(3)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。
t/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
从反应开始到5min末,用H2浓度变化表示的平均反应速率v(H2)= ;反应达到平衡状态,此时H2的转化率为 。
(4)在相同温度、容积不变的条件下,能说明该反应已达平衡状态的是 (填序号)。
a.CO2、H2、CH3OH、H2O的浓度均不再变化
b.v生成(CH3OH)=v消耗(CO2)
c.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶1∶1∶1
d.容器中混合气体的密度保持不变
e. H2的消耗速率与CH3OH的消耗速率之比为3∶1
f.体系压强不变
(5)以CH3OH、空气、氢氧化钾溶液为原料,石墨为电极可构成然料电池,该电池中负极上的电极反应式是:_____________________________________。
【答案】(1)放热;(2)ac;(3)0.15mol·(L·min)-1,75%;(4)a、e、f;(5)CH3OH+8OH―—6e― =CO32―+6H2O。
【解析】
试题分析:(1)反应物的总能量高于生成物的总能量,此反应是放热反应;(2)a、升高温度,反应速率加快;b、恒容时,充入非反应气体,各组分的浓度不变,反应速率不变;c、加入催化剂,加快反应速率;d、降低压强,减缓反应速率;(3)v(CO2)=(1-0.5)/(2×5)mol/(L·min)=0.05 mol/(L·min),根据化学反应速率之比等于系数之比,则v(H2)=3v(CO2)=3×0.05mol/(L·min)=0.15mol/(L·min),消耗的氢气的物质的量n(H2)=3×(1-0.25)mol=2.25mol,氢气的转化率=2.25/3×100%=75%;(4)a、根据化学平衡状态的定义,各组分的浓度不再改变,说明达到平衡;b、生成甲醇和消耗CO2,反应方向都是向正反应方向移动的,因此不能作为达到化学平衡的标志;c、不能通过物质的量比值,来判断达到化学平衡的标志;d、根据密度的定义式,组分都是气体,则气体质量不变,因为是恒容,容器的体积不变,因此密度不能作为达到化学平衡的标志;e、消耗氢气和消耗甲醇反应方向是一正一逆,且速率之比为3:1,能作为达到化学平衡的标志;f、反应前后气体系数之和不相等,因此当压强不再改变,说明反应达到平衡;(5)通燃料的一极为负极,其反应式为:CH3OH+8OH―—6e― =CO32―+6H2O。


科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数,下列叙述错误的是
A.1molC10H22分子中共价键总数为31NA个
B.0.1molCH4中含有NA个电子
C.标准状况下,22.4LCHCl3含有氯原子数目为3NA个
D.标准状况下,22.4L甲烷和乙烷混合气体中的分子数NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在原电池和电解池的电极上所发生的反应,同属还原反应的是 ( )
A.原电池正极和电解池阳极所发生的反应
B.原电池正极和电解池阴极所发生的反应
C.原电池负极和电解池阳极所发生的反应
D.原电池负极和电解池阴极所发生的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析生产生活中的下列过程,不涉及氧化还原反应的是( )
A.煤液化制得清洁能源 B.人工固氮
C.将氯气通入冷的消石灰中制漂白粉 D.从海水中提取氯化镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)完全燃烧0.1 mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9 g,浓碱液增重17.6 g。该烃的化学式为______,并写出其所有可能的结构简式:__________________。
(2)某烷烃的相对分子质量为128,该烷烃的化学式为__________________。
(3)在120 ℃和101 kPa的条件下,某气态烃和一定质量的氧气混合,点燃完全反应后再恢复到原来的温度时,气体体积不变,则该烃分子内的氢原子个数______。
A.小于4 B.大于4
C.等于4 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列液体中,不会出现丁达尔效应的分散系是 ( )
①鸡蛋白溶液 ②水 ③淀粉溶液 ④硫酸钠溶液 ⑤沸水中滴入饱和FeCl3溶液
A.④ B.③④ C.②④ ⑤ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属于加成反应的是( )
A.乙炔通入酸性高锰酸钾溶液中,溶液褪色
B.苯滴入溴水中,振荡后溴水层接近无色
C.油脂的皂化反应
D.将裂化获得的汽油滴入溴水中,溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年12月17日,中国国土资源部召开新闻发布会,宣布在广东沿海珠江口盆地东部海域首次钻获高纯度可燃冰。可燃冰的主要成分是甲烷,甲烷既是清洁的燃料,也是重要的化工原料。
(1)甲烷和二氧化碳重整制合成气,对于温室气体的治理具有重大意义。
已知:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)ΔH=+247.3 kJ·mol-1
2CO(g)+2H2(g)ΔH=+247.3 kJ·mol-1
CH4(g)![]() C(s)+ 2H2(g) ΔH=+75 kJ·mol-1
C(s)+ 2H2(g) ΔH=+75 kJ·mol-1
①反应2CO(g)![]() C(s)+CO2(g)在一定条件下能自发进行的原因是 。
C(s)+CO2(g)在一定条件下能自发进行的原因是 。
②合成甲醇的主要反应是:2H2(g)+CO(g)![]() CH3OH(g)ΔH=-90.8 kJ·mol-1,T ℃下此反应的平衡常数为160。某时刻测得各组分的浓度如下:
CH3OH(g)ΔH=-90.8 kJ·mol-1,T ℃下此反应的平衡常数为160。某时刻测得各组分的浓度如下:
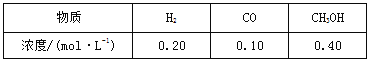
比较此时正、逆反应速率的大小:v(正) v(逆)(填“>”、“<”或“=”)。生产过程中,合成气要进行循环,其目的是 。
③在一恒容密闭容器中,要提高反应2H2(g)+CO(g)![]() CH3OH(g)中CO的转化率,可以采取的措施是 。
CH3OH(g)中CO的转化率,可以采取的措施是 。
a.升温
b.加入催化剂
c.增加CO的浓度
d.加入H2
e.加入惰性气体
f.分离出甲醇
(2)以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。
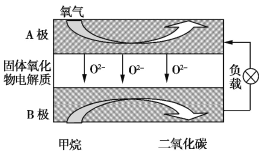
①B极为电池 极,电极反应式为 。
②若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗甲烷的体积为 (标况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙烯为原料合成化合物C的流程如图所示:

(1)B中含有的官能团名称为___________。
(2)写出A的结构简式:_______________________________。
(3)①、④的反应类型分别为__________反应、__________反应。
(4)写出反应②和④的化学方程式:
②________________________________________________________________;
④________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com