
【题目】W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化趋势如图所示。已知W的一种核素的质量数为18,中子数为10;X是短周期中金属性最强的元素;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强。下列说法正确的是( )
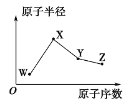
A.对应气态氢化物的稳定性:Y > W
B.对应简单离子的半径:W>Z
C.化合物XZW中既含离子键又含共价键
D.Y的氧化物能与Z的最高价氧化物对应的水化物反应
科目:高中化学 来源: 题型:
【题目】如图是几种晶体的结构示意图,它们是NaCl、干冰、金刚石、石墨结构中的一部分。
A.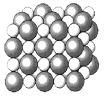 B.
B.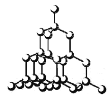 C.
C.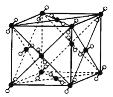 D.
D.
(1)其中代表金刚石的是______(填序号),金刚石属于______晶体。
(2)其中代表石墨的是______(填序号),其晶体中碳原子呈平面层状结构排列。
(3)其中代表NaCl的是______(填序号),晶体中Na+与Cl-之间通过______结合。
(4)其中代表干冰的是______(填序号),它属于晶体______,CO2分子间通过______结合。
(5)A、B、C所代表物质的熔点由高到低的排列顺序为______(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。查阅资料知SO3的熔点为16.83℃,沸点是44.8℃。某化学学习小组欲通过实验测定上述反应中SO2的转化率,他们设计了如下实验。
2SO3(g) ΔH<0。查阅资料知SO3的熔点为16.83℃,沸点是44.8℃。某化学学习小组欲通过实验测定上述反应中SO2的转化率,他们设计了如下实验。

请根据要求回答问题:
(1)各装置接口的连接顺序是a→__。
(2)装置Ⅳ烧杯中盛放冰水的作用是__。
(3)装置Ⅰ所用硫酸,一般选用浓度为70%~80%的硫酸,原因是__。
(4)当装置Ⅰ中反应结束时,要打开止水夹继续通入O2一段时间,继续通入O2的目的是__。
(5)称量agNa2SO3粉末与足量硫酸反应,实验结束后称得装置Ⅳ增重bg,列式表示该实验中SO2的转化率__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加徳罗常数的值,下列说法正确的是
A.电解精炼铜时转移了NA个电子,阳极溶解了32g铜
B.室温下,pH=3的NH4Cl溶液中,由水电离的OH-浓度为10-11mol/L
C.12.0g熔融的NaHSO4中含有的阳离子数为0.1NA
D.常温下,1mol/LFe2(SO4)3溶液中,Fe3+和SO42-的离子总数是NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是
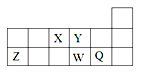
A. 离子半径的大小顺序为:r(W2-)>r(Q-)>r(Y2-)>r(Z3+)
B. 元素W的最高价氧化物对应水化物的酸性比Q的强
C. 元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键
D. X、Z、W、Q四种元素的最高价氧化物对应水化物均能与强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.向0.1mol/LCH3COOH溶液中加入少量水,溶液中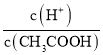 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中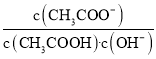 增大
增大
C.向盐酸中加入氨水至中性,溶液中c(NH4+):c(Cl-)>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中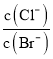 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表前四周期的一部分,下列有关W、X、Y、Z、R五种元素的叙述正确的是( )
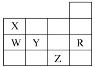
A. 常温下,Z的单质为气态物质
B. Y、Z的阴离子的电子层结构都与R原子的相同
C. W的氢化物的稳定性要比X的强
D. Y的元素的非金属性比W元素强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数大于4的主族元素Xm+、Yn-的离子核外电子层结构相同,则关于X、Y两元素的叙述正确的是
A. X的原子序数小于Y的原子序数 B. X、Y的核电荷数之差是(m-n)
C. X和Y处于同一周期 D. Y元素与X元素的族序数之差是8-(m+n)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10 L密闭容器中,A、B、C三种气态物质构成了可逆反应的体系;当在某一温度时,A、B、C物质的量与时间的关系如图甲,C的百分含量与温度的关系如图乙。
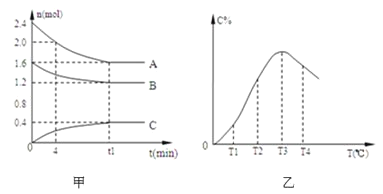
下列分析不正确的是( )
A.0~4 min时,A的平均反应速率为0.02 mol·L-1·min-1
B.该反应的化学方程式为2A(g)+B(g)C(g)
C.由T1向T2变化时,正反应速率大于逆反应速率
D.该反应正反应是放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com