
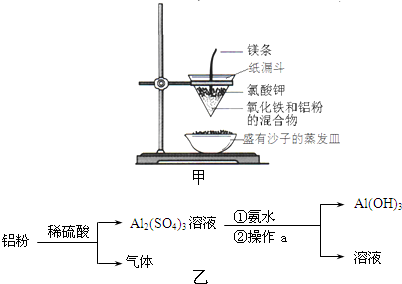
| ||
| ||
| ||
| ЭЈЕчЃЌNa3AlF6 |
| ||
| ЭЈЕчЃЌNa3AlF6 |



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
| ОЛКЌСПЃК500mL | |
| вћгУЫЎПѓЮяжЪГЩЗжЃЈmgЃЎL-1ЃЉ | |
| ИЦCa | Ён4.0 |
| УОMg | Ён1.0 |
| ФЦNa | Ён3.0 |
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЃЈ1ЃЉПѓШЊЫЎжаЭљЭљКЌЖржжгавцгкШЫЬхНЁПЕЕФГЩЗжЁЃгвЭМЪЧФГЦЗХЦПѓШЊЫЎжаБъЧЉЩЯЕФВПЗжФкШнЃЌдђетЦППѓШЊЫЎжаКЌCa2+ЕФЮяжЪЕФСПЁн Ёј molЁЃ

ЃЈ2ЃЉЯжДњЩњЛюРыВЛПЊТСЃЌЙЄвЕЩЯвдТСЭСПѓЮЊдСЯЩњВњТСЁЃ
ЯжНЋвЛЖЈСПФГТСЭСПѓбљЦЗЃЈжївЊГЩЗжAl2O3ЃЉШмгкЙ§СПЯЁбЮЫсВЂжЦГЩ500 mLШмвКЁЃШЁ
100 mLИУШмвКЃЌВтЕУЦфжаКЌгаH+ЁЂCl-ЁЂMg2+ЁЂAl3+ЁЂFe3+ЮхжжРызгЃЈВЛПМТЧЦфЫќРызгЃЉЁЃ
вбжЊВПЗжРызгЕФЮяжЪЕФСПХЈЖШЮЊЃК
cЃЈH+ЃЉ = 0.02 molЁЄL-1 cЃЈMg2+ЃЉ = 0.01 molЁЄL-1
cЃЈFe3+ЃЉ= 0.02 molЁЄL-1 cЃЈCl-ЃЉ = 0.52 molЁЄL-1
ЂйШмвКжаAl3+ЮяжЪЕФСПХЈЖШЮЊ Ёј molЁЄL-1k*s5*u
ЂкдђИУТСЭСПѓбљЦЗжаAl2O3ЕФжЪСПЮЊ Ёј gЃЈОЋШЗжС0.01 gЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК2012-2013бЇФъеуНРжЧхЕкЖўжабЇИпвЛЕкЖўДЮЃЈ12дТЃЉдТПМЛЏбЇЪдОэЃЈДјНтЮіЃЉ ЬтаЭЃКЬюПеЬт
ЃЈ4ЗжЃЉЯжДњЩњЛюРыВЛПЊТСЃЌЙЄвЕЩЯвдТСЭСПѓЮЊдСЯЩњВњТСЁЃЯжНЋвЛЖЈСПФГТСЭСПѓбљЦЗЃЈжївЊГЩЗжAl2O3ЃЉШмгкЙ§СПЯЁбЮЫсВЂжЦГЩ500 mLШмвКЁЃШЁ100 mLИУШмвКЃЌВтЕУЦфжаКЌ гаH+ЁЂClЈDЁЂMg2ЃЋЁЂAl3ЃЋЁЂFe3ЃЋ ЮхжжРызгЃЈВЛПМТЧЦфЫќРызгЃЉЁЃвбжЊВПЗжРызгЕФЮяжЪЕФСПХЈЖШЮЊЃК
cЃЈHЃЋЃЉ = 0.02 molЁЄLЈD1 cЃЈMg2ЃЋЃЉ= 0.01 molЁЄLЈD1
cЃЈFe3ЃЋЃЉ= 0.02 molЁЄLЈD1 cЃЈClЈDЃЉ = 0.52 molЁЄLЈD1
ЃЈ1ЃЉШмвКжаAl3ЃЋ ЮяжЪЕФСПХЈЖШЮЊ molЁЄLЈD1
ЃЈ2ЃЉдђИУТСЭСПѓбљЦЗжаAl2O3ЕФжЪСПЮЊ gЁЃЃЈОЋШЗжС0.01 gЃЉ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК2015НьеуНРжЧхЕкЖўжабЇИпвЛЕкЖўДЮЃЈ12дТЃЉдТПМЛЏбЇЪдОэЃЈНтЮіАцЃЉ ЬтаЭЃКЬюПеЬт
ЃЈ4ЗжЃЉЯжДњЩњЛюРыВЛПЊТСЃЌЙЄвЕЩЯвдТСЭСПѓЮЊдСЯЩњВњТСЁЃЯжНЋвЛЖЈСПФГТСЭСПѓбљЦЗЃЈжївЊГЩЗжAl2O3ЃЉШмгкЙ§СПЯЁбЮЫсВЂжЦГЩ500 mLШмвКЁЃШЁ100 mLИУШмвКЃЌВтЕУЦфжаКЌ гаH+ЁЂClЈDЁЂMg2ЃЋЁЂAl3ЃЋЁЂFe3ЃЋ ЮхжжРызгЃЈВЛПМТЧЦфЫќРызгЃЉЁЃвбжЊВПЗжРызгЕФЮяжЪЕФСПХЈЖШЮЊЃК
cЃЈHЃЋЃЉ = 0.02 molЁЄLЈD1 cЃЈMg2ЃЋЃЉ= 0.01 molЁЄLЈD1
cЃЈFe3ЃЋЃЉ= 0.02 molЁЄLЈD1 cЃЈClЈDЃЉ = 0.52 molЁЄLЈD1
ЃЈ1ЃЉШмвКжаAl3ЃЋ ЮяжЪЕФСПХЈЖШЮЊ molЁЄLЈD1
ЃЈ2ЃЉдђИУТСЭСПѓбљЦЗжаAl2O3ЕФжЪСПЮЊ gЁЃЃЈОЋШЗжС0.01 gЃЉ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com