
【题目】中学化学中很多“规律”都有适用范围,下列根据有关“规律”推出的结论错误的有( )
序号 | 规律 | 结论 |
① | 活泼金属的氧化物为碱性氧化物 |
|
② | 酸与酸性氧化物不能发生反应 | 氢氟酸可以储存在玻璃试剂瓶中 |
③ | 较弱酸不能制取较强酸 | 氢硫酸不能制取硫酸 |
④ | 复分解反应均不是氧化还原反应 | 酸碱中和反应中没有电子的转移 |
A.①②③B.②③④C.①③④D.①②④
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】25℃时在10mL0.1mol·L-1Na2CO3溶液中逐滴加入0.1mol·L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示。下列说法不正确的是( )

A.A点时:c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+)
B.当溶液的pH=8时,溶液中NaHCO3的物质的量浓度为0.1moL·L-1
C.a、b曲线分别代表的是HCO3-、H2CO3量的变化情况
D.Na2CO3溶液中c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
查看答案和解析>>
科目:高中化学 来源: 题型:
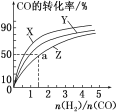
【题目】(1)工业上一般以CO和H2为原料在密闭容器中合成甲醇:CO(g)+2H2(g) ===CH3OH(g) ΔH=-90.8 kJ·mol-1。在容积为1 L的恒容容器中,分别研究在230 ℃、250 ℃和270 ℃三种温度下合成甲醇的规律。
如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线Z对应的温度是__________。
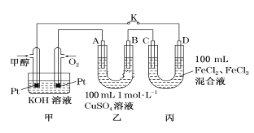
(2)如图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。
Ⅰ.甲中负极的电极反应式为__________________________。
Ⅱ.乙中反应的化学方程式为_________________________________;A极析出的气体在标准状况下的体积为________。
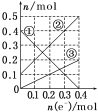
Ⅲ.丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图,则图中②线表示的是________的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要______ mL 5.0 mol·L-1 NaOH溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入A、B、C三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如下表。
测定时刻/s | t1 | t2 | t3 | t4 |
c(A)/(mol·L-1) | 6 | 3 | 2 | 2 |
c(B)/(mol·L-1) | 5 | 3.5 | 3 | 3 |
c(C)/(mol·L-1) | 1 | 2.5 | 3 | 3 |
据此判断下列结论正确的是( )
A.在t3时刻反应已经停止
B.t1~t4时刻,A的转化率比B的转化率低
C.在容器中发生的反应为2A+B![]() 2C
2C
D.增大压强,达平衡时混合气体的平均相对分子质量增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料可以回收再利用,而且对周边环境不构成任何污染.PETG的结构简式如下:
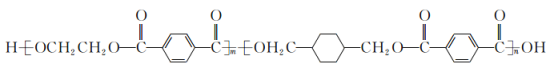
这种材料可采用下图所示的合成路线;
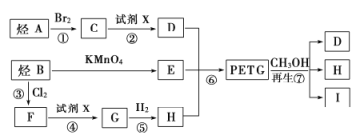
已知;(1)![]()
(2)![]() (R、
(R、![]() 、
、![]() 表示烃基)
表示烃基)
请回答下列问题:
(1)⑦的反应类型是_____________,试剂X为_____________.
(2)写出Ⅰ的结构简式:____________
(3)合成时应控制的单体的物质的量:![]() _____________(用m,n表示).
_____________(用m,n表示).
(4)写出反应②的化学方程式:____________________________________.
(5)与E的分子式相同,且满足下列条件的同分异构体有_____________种.
①能与![]() 溶液反应产生
溶液反应产生![]() ②能发生银镜反应 ③遇
②能发生银镜反应 ③遇![]() 溶液显紫色
溶液显紫色
(6)D和E在催化剂作用下可生产一种聚酯纤维——涤纶,请写出生产该物质的化学方程式:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
①溴水中存在化学平衡:Br2+H2O![]() HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
②铁在潮湿的空气中易生锈
③二氧化四氧化二氮的平衡体系,压缩体积后颜色加深
④工业合成氨反应(放热)为加快反应速率,将温度升高到500℃左右
⑤钠与氯化钾共融制备钾:Na(l)+KCl(l)![]() K(g)+NaCl(l)
K(g)+NaCl(l)
A.①④⑤B.①②③C.②③④D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L容器中三种物质的物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式和反应开始至2 min末Z的平均反应速率分别为( )
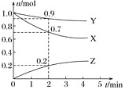
A.X+3Y![]() 2Z 0.1 mol L-1min-1B.2X+Y
2Z 0.1 mol L-1min-1B.2X+Y![]() 2Z 0.1 mol L-1min-1
2Z 0.1 mol L-1min-1
C.X+2Y![]() Z 0.05 mol L-1min-1D.3X+Y
Z 0.05 mol L-1min-1D.3X+Y![]() 2Z 0.05 mol L-1min-1
2Z 0.05 mol L-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将1.0 mol的HI(g)通入体积为1.0 L的密闭容器中,实验测得HI(g)的最大分解率为22.2%,则该温度下,反应![]() H2(g) +
H2(g) +![]() X2(g)
X2(g)![]() HX(g)平衡常数接近于( )
HX(g)平衡常数接近于( )
A.0.02B.0.15C.7D.49
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com