
【题目】如图是可逆反应![]() 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
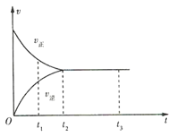
A.t1时,反应只向正方向进行B.t2时,反应未达到限度
C.t2~t3,反应已停止D.t2~t3,各物质的浓度不再发生变化
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】向铝土矿![]() 含
含![]() 、FeO、
、FeO、![]() 、
、![]() 中加入适量硫酸溶液,分别取浸取液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
中加入适量硫酸溶液,分别取浸取液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
A.通入过量![]() :
:![]() 、
、![]() 、
、![]() 、
、![]()
B.通入过量氨气:![]() 、
、![]() 、
、![]() 、
、![]()
C.加入过量NaOH溶液:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
D.加入过量NaClO溶液:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b是多孔石墨电极。某同学按图示装置进行如下实验:断开K2,闭合K1一段时间,观察到两支玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转。下列说法不正确的是( )

A.断开K2,闭合K1一段时间,溶液的pH变大
B.断开K1,闭合K2时,b极上的电极反应为2H++2e-=H2↑
C.断开K2,闭合K1时,a极上的电极反应为4OH--4e-=O2↑+2H2O
D.断开K1,闭合K2时,OH-向b极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性条件下,KMnO4与H2C2O4发生氧化还原反应,用0.1 mol·L1的KMnO4与过量的H2C2O4反应,测得Mn2+的生成速率v与时间t的趋势如图,下列说法正确的是( )

A. 该反应中每生成1 mol CO2转移电子为10 mol
B. 方程式配平后,H2O的系数为6
C. 反应开始很短一段时间内v减小是因为反应物浓度减小,后来突然增大是因为生成的Mn2+对该反应有催化作用
D. t0时,Mn2+的浓度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种工业酸性废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl-、![]() )中回收氧化铁流程如图所示:
)中回收氧化铁流程如图所示:

已知:常温下Ksp[Mg(OH)2]=1.2×10-11;Ksp[Fe(OH)2]=2.2×10-16;Ksp[Fe(OH)3]=3.5×10-38;Ksp[Al(OH)3]=1.0×10-33
(1)写出在该酸性废液中通入空气时发生反应的离子方程式: _________,指出使用空气比使用氯气好的原因是__________。
(2)已知Fe3+(aq)+3OH-(aq)=Fe(OH)3(s) ΔH=-Q1 kJ·mol-1,题(1)中每生成1 mol含铁微粒时,放热Q2,请你计算1 mol Fe2+全部转化为Fe(OH)3(s)的热效应ΔH=________。
(3)常温下,根据已知条件计算在pH=5的溶液中,理论上Fe3+在该溶液中可存在的最大浓度c(Fe3+)=____________。
(4)有人用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时可能混有的杂质是________(填化学式,下同),用________试剂可将其除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2A(g)+B(g)![]() 3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
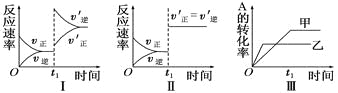
A. 图Ⅰ表示的是t1时刻增大反应物的浓度对反应速率的影响
B. 图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响
C. 图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高
D. 图Ⅲ表示的是不同催化剂对平衡的影响,且甲的催化效率比乙高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛是乙烯聚合催化剂的重要成分,制备反应如下:
①TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)ΔH1=+175.4kJ·mol-1
②C(s)+![]() O2(g)=CO(g)ΔH2=-110.45kJ·mol-1
O2(g)=CO(g)ΔH2=-110.45kJ·mol-1
下列说法正确的是
A.C的燃烧热是-110.45kJ·mol-1
B.若反应①中使用催化剂加快反应速率,单位时间内吸收更多热量,则ΔH1变大
C.反应①中的能量变化如图所示
D.反应TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g)ΔH=-45.5kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
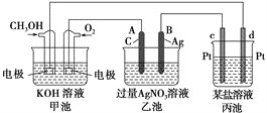
【题目】如图是一个化学过程的示意图。已知甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O
请回答:
(1)甲池是________池,通入O2的电极作为________极,电极反应式为__________。
(2)乙池是________池,A电极名称为________极,电极反应式为_______________。乙池中的总反应离子方程式为_____________________________________________,溶液的pH________(填“增大”、“减小”或“不变”)。
(3)当乙池中B(Ag)极的质量增加5.40 g时,甲池中理论上消耗O2________mL(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二乙酸—1,4—环己二醇酯可通过下列路线合成:
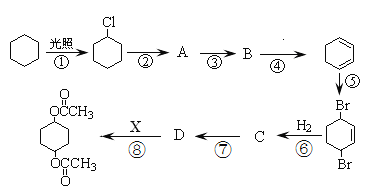
(1)化合物的结构简式:B___;D___。
(2)上述合成过程中没有涉及的反应类型是___。
A.加成 B.消去 C.取代 D.氧化 E.聚合 F.酯化
(3)反应④和反应⑧的反应条件:④___;⑧___。
(4)写出②的反应方程式___;写出⑤的反应方程式___。
(5)请设计合理的方案以CH2=CH—CH=CH2(1,3—丁二烯)和醋酸为原料合成 (用合成路线流程图表示,并注明反应条件)___。
(用合成路线流程图表示,并注明反应条件)___。
提示:①合成过程中无机试剂任选;②合成路线流程图示例如:
CH3CH2OH![]() H2C=CH2
H2C=CH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com