
【题目】水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s)+H2O(g)CO(g)+H2 (g)△H=+131.3kJmol﹣1
(1)该反应的平衡常数K随温度的升高而(增大/减小/不变).
(2)上述反应达到平衡后,将体系中的C(s)全部移走,平衡(向左移/向右移/不移动).
(3)下列事实能说明该反应在一定条件下已达到平衡状态的有(填序号).
A.单位体积内每消耗1mol CO的同时生成1molH2
B.混合气体总物质的量保持不变
C.生成H2O(g)的速率与消耗CO的速率相等
D.H2O(g)、CO、H2的浓度相等
(4)某温度下,将4.0mol H2O(g)和足量的炭充入2L的密闭容器中,发生如下反应,C(s)+H2O(g)CO (g)+H2 (g),达到平衡时测得K=1,则此温度下H2O(g)的转化率为
(5)己知:①C (s)+H2O(l)CO (g)+H2 (g)△H1
②2CO(g)+O2(g)═2CO2(g)△H 2
③H2O(l)═H2(g)+ ![]() O2(g)△H 3
O2(g)△H 3
则2C(s)+2O2(g)═2CO2(g)的△H= .
【答案】
(1)增大
(2)向左移
(3)AB
(4)50%
(5)2△H1+△H2﹣2△H3
【解析】解:(1.)该反应正反应是吸热反应,升高温度平衡向正反应方向移动,平衡常数增大;所以答案是:增大;
(2.)将C全部移走,由于是可逆反应,还会生成碳,生成的碳不能完全反应,故平衡向左移动,所以答案是:向左移;
(3.)C(s)+H2O(g)CO(g)+H2(g)△H=+131.3kJmol﹣1 , 反应是气体体积增大的放热反应;分析选项正逆反应速率相同是平衡标志;
A.单位体积内每消耗1mol CO的同时生成1molH2 , 说明对一氧化碳或氢气正逆反应速率相同,故A正确;
B.反应前后气体物质的量变化,混合气体总物质的量保持不变说明反应达到平衡状态,故B正确;
C.生成H2O(g)的速率与消耗CO的速率相等只能说明反应逆向进行,不能说明反应达到平衡状态,故C错误;
D.H2O(g)、CO、H2的浓度相等和起始量变化量有关,不能作为平衡标志,故D错误;所以答案是:AB;
(4.)设H2O转化了xmol/L,依据化学平衡三段式列式计算;
C (s) | + | H2O(g) | CO (g) | + | H2 (g) | ||
初始浓度(mol/L) | 2.0 | 0 | 0 | ||||
转化浓度(mol/L) | x | x | x | ||||
平衡浓度(mol/L) | 2.0﹣x | x | x |
达到平衡时测得K=1
K= ![]() =
= ![]() =1,解得x=1mol/L
=1,解得x=1mol/L
所以α(H2O)= ![]() ×100%=50%;所以答案是:50%;
×100%=50%;所以答案是:50%;
(5.)①C (s)+H2O(l)CO(g)+H2(g)△H1②2CO(g)+O2(g)═2CO2(g)△H2③H2O(l)═H2 (g)+ ![]() O2(g)△H3
O2(g)△H3
依据盖斯定律计算①×2+②﹣2×③得到,C(s)+O2(g)═CO2(g)△H=2△H1+△H2﹣2△H3;
所以答案是:2△H1+△H2﹣2△H3 .
【考点精析】解答此题的关键在于理解化学平衡状态的判断的相关知识,掌握状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等,以及对化学平衡的计算的理解,了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】将SO2分别通入下列4种溶液中,请回答下列问题:
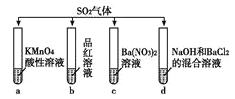
(1)试管a出现溶液褪色的现象,说明SO2具有________性;试管b出现溶液褪色的现象,说明SO2具有________性。
(2)试管d出现白色沉淀,该沉淀能够溶解在稀盐酸中,写出生成该沉淀的离子方程式:________________。
(3)如果将试管d中的NaOH更换为Br2和BaCl2的混合溶液,可以得到一种难溶于强酸的白色沉淀;写出该过程中发生氧化还原反应的离子方程式:________。
(4)试管c中也可得到难溶于强酸的白色沉淀,请你简述该沉淀的生成原因:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素W,X,Y,Z的原子序数依次增大,W,X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性.下列说法正确的是( )
A.简单离子半径:W<X<Z
B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:W<Y
D.最高价氧化物的水化物的酸性:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、CuO、MgSO4溶液、Ba(OH)2溶液、稀盐酸五种物质,在常温下两种物质间能发生的化学反应有
A. 6个 B. 5个 C. 4个 D. 3个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X,Y,Z三种短周期元素,原子半径的大小关系为:r (Y)>r(X)>r(Z),原子序数之和为16。X,Y,Z三种元素的常见单质在适当条件下可发生右图所示变化,其中B和C均为10电子分子。下列说法不正确的是( )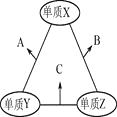
A.X元素位于ⅥA族
B.A不能溶于B中
C.A和C不可能发生氧化还原反应
D.B的沸点高于C的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题: 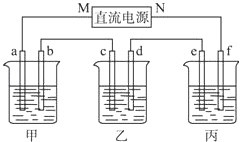
(1)电源的N端为极.
(2)电极b上发生的电极反应为 .
(3)列式计算电极b上生成的气体在标准状况下的体积 .
(4)电极c的质量变化是g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁发生吸氧腐蚀时,正极上发生的电极反应是( )
A.2H++2e﹣═H2↑
B.Fe2++2e﹣═Fe
C.2H2O+O2+4e﹣═4OH﹣
D.Fe3++e﹣═Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“心得安”是治疗心脏病的药物,下面是它的一种合成路线(具体反应条件和部分试剂略): 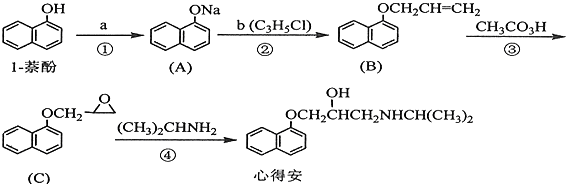
回答下列问题:
(1)试剂a是 , b中官能团的名称是 .
(2)②的反应类型是 .
(3)心得安的分子式为 .
(4)芳香化合物D是1﹣萘酚的同分异构体,其分子中有两个官能团,能发生银镜反应,D能被KMnO4酸性溶液氧化成E( C2H4O2) 和芳香化合物F (C8H6O4),E和F与碳酸氢钠溶液反应均能放出CO2气体,F芳环上的一氯代物只有一种.D的结构简式为;由F生成一硝基产物的化学方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com