
【题目】下列关于金属铝的叙述中,正确的是
A. 铝是地壳中含量最多的元素
B. 铝是比较活泼的金属,在化学反应中容易失去电子,表现氧化性
C. 与铝反应产生H2的溶液一定呈酸性
D. 铝箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al 并不滴落
科目:高中化学 来源: 题型:
【题目】在元素周期表中,第三、四、五、六周期元素的数目分别是
A. 8、8、18、32 B. 8、18、18、32 C. 8、18、18、18 D. 8、8、18、18
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al—Ag2O电池可用作水下动力电源,其原理如图所示。电池工作时,下列说法错误的是
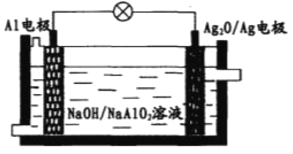
A. 电子由Al电极通过外电路流向Ag2O/Ag电极
B. 电池负极附近溶液pH升高
C. 正极反应式为Ag2O+2e-+H2O=2Ag+2OH-
D. 负极会发生副反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将过量SO2通入下列溶液中,能出现白色浑浊的是
①Ca(OH)2;②BaCl2;③NaHCO3;④Na2CO3;⑤Ba(NO3)2
A. ①②④ B. ②③ C. ④⑤ D. ⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A. 常温常压下,11.2 L氧气所含的原子数为NA
B. 1.8 g的NH4+离子中含有的质子数为NA
C. 常温常压下,48 g O3和O2的混合物含有的氧原子数为3NA
D. 2.4 g金属镁变为镁离子时失去的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关镁的叙述正确的是( )
A. 工业制造的镁蒸气通常在H2或N2中冷却
B. 镁条燃烧引发的火灾可用CO2来扑灭
C. 镁在空气中燃烧的产物并不全是MgO
D. 镁制容器可用来贮存和运输浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铜矿(主要成分二硫化亚铁铜CuFeS2为原料,用Fe2(SO4)3溶液作浸取剂提取铜,总反应的离子方程式是:CuFeS2+4Fe3+=Cu2++5Fe2++2S
(1)上述总反应的原理如图1所示。正极的电极反应式是_______________________________。
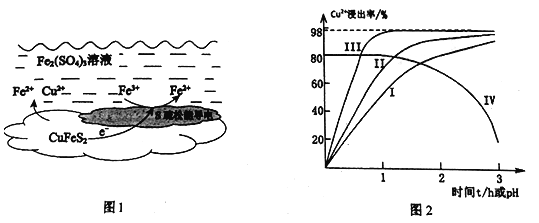
(2)一定温度下,控制浸取剂pH=1,总体积为1L,取三份相同质量黄铜矿粉末分别进行实验,结果如图2:
实验 | 操作 |
I | 加入足量0.100 molL-1Fe2(SO4)3溶液 |
II | 加入足量0.100 molL-1Fe2(SO4)3溶液,通入空气 |
Ⅲ | 加入足量0.100 molL-1Fe2(SO4)3溶液,再加入少量 0.000500 molL-1Ag2SO4溶液 |
①曲线IV是在实验I的基础上改变溶液的pH所得实验结果,请分析pH从2到3,Cu2+浸出率明显下降的原因____________________________(用离子方程式描述)。
②对比实验I、Ⅱ,通入空气,Cu2+浸出率提髙的原因是_________________________。
③由实验Ⅲ推测,在浸取Cu2+过程中Ag+作催化剂,催化原理是:
i . CuFeS2+4Ag+=Fe2++Cu2++2Ag2S
ii.……
写出上述ii的离子方程式_____________________________________________。
为证明该催化原理,进行如下实验:
a.取少量黄铜矿粉末,加入少量0.0005mol·L-lAg2SO4溶液,充分混合后静置。取上层淸液,加入稀盐酸,观察到溶液中_______________________,证明发生反应i
b.取少量Ag2S粉末,加入________________溶液,充分混合后静置。取上层淸液,加入稀盐酸,有白色沉淀,证明发生反应ii
④若实验中样品含铜a mol,则实验I的平衡常数K=_____________(杂质不参与反应,只要求列出计算式,不必算出结果)。
(3)为了进一步研究上述实验Ⅲ结论的可靠性,査得资料Ksp(Ag2S)=6.4×10-50,Ksp(AgCl)=1.8×10-10,试计算,使饱和Ag2S溶液中的Ag+开始转化为AgCl沉淀所需盐酸的最低浓度为____________ mol/L (己知![]() ≈2.5)。
≈2.5)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关钠的叙述中错误的是( )
A. 电解法冶炼金属钠时,钠在阳极析出
B. 钠的化学性质非常活泼,钠元素只能以化合态存在于自然界
C. 钠的还原性很强,可以用来冶炼金属钛、锆、铌等
D. 钠的质地软,可用小刀切割
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5 有机化学基础】
某抗结肠炎药物有效成分的合成路线如下(部分反应略去试剂和条件):

已知:
请回答下列问题:
(1)抗结肠炎药物有效成分的分子式是: ;烃A的名称为: ;反应②的反应类型是: 。
(2)①下列对该抗结肠炎药物有效成分可能具有的性质推测正确的是: ;
A.水溶性比苯酚好
B.能发生消去反应也能发生聚合反应
C.1mol该物质最多可与4mol H2发生反应
D.既有酸性又有碱性
② E与足量NaOH溶液反应的化学方程式是: 。
(3)符合下列条件的抗结肠炎药物有效成分的同分异构体有______种。
A.遇FeCl3溶液有显色反应
B.分子中甲基与苯环直接相连
C.苯环上共有三个取代基
(4)已知:苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位,据此按先后顺序写出以A为原料合成邻氨基苯甲酸(![]() )合成路线中两种中间产物的结构简式(部分反应条件已略去)
)合成路线中两种中间产物的结构简式(部分反应条件已略去)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com