
【题目】请根据题意,选择恰当的选项用字母代号或文字填空。
(1)中国的高铁技术居于国际领先地位。
①高铁座椅内填充有聚氨酯软质泡沫。聚氨酯属于___(填字母代号,下同)。
a.金属材料 b.无机非金属材料 c.有机高分子材料
②高铁信息传输系统中使用了光导纤维。光导纤维的主要成分是___。
a.铜 b.石墨 c.二氧化硅
③高铁轨道建设需用大量水泥。生产水泥的主要原料为黏土和___。
a.石灰石 b.粗盐 c.纯碱
④高铁轨道建设铺设的铁轨属于___(填“金属铁”或“铁合金”)。
(2)煤炭在我国能源结构中占有重要地位,合理使用有利于社会可持续发展。
①控制燃煤产生的___(填化学式)排放,能够减少硫酸型酸雨的形成。
②煤的气化和液化是实现能源清洁化的重要途径。水煤气中CO和H2在加热、加压和催化剂存在条件下可以合成液体燃料(CH3OH),该反应的化学方程式为___。煤的干馏属于__(填“化学变化”或“物理变化”)。
(3)营养均衡有利于身体健康。
①人体内提供能量的主要营养物质为___、糖类和蛋白质。
②维生素是人体需要的营养物质。如图为某品牌维生素C泡腾片说明书的部分内容。该泡腾片中添加的着色剂是___。

③泡腾片溶于水时产生“沸腾”效果,是由于添加的酒石酸和___(填物质名称)反应释放出了气体。
【答案】c c a 铁合金 SO2 CO+2H2![]() CH3OH 化学变化 油脂 喹啉黄 碳酸氢钠
CH3OH 化学变化 油脂 喹啉黄 碳酸氢钠
【解析】
(1)①聚氨酯属于有机高分子材料,所以选c;
②光导纤维的主要成分是二氧化硅,所以选c;
③生产水泥的主要原料为黏土和石灰石,所以选a;
④高铁轨道建设铺设的铁轨属于铁合金;
(2)①控制燃煤产生的SO2排放,能够减少硫酸型酸雨的形成;
②反应物为CO和H2,产物为CH3OH,根据元素守恒可得方程式为CO+2H2![]() CH3OH;煤的干馏过程中有新物质生成,属于化学变化;
CH3OH;煤的干馏过程中有新物质生成,属于化学变化;
(3)①人体内提供能量的主要营养物质为糖类、油脂、蛋白质;
②根据题目所给的药品的主要成分可知着色剂为喹啉黄;
③泡腾片溶于水时产生“沸腾”效果,是由于添加的酒石酸和碳酸氢钠反应放出了二氧化碳。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某工厂的工业硫酸盐废水中含有大量的Fe2+、Fe3+、较多的Cu2+和少量的Na+。工厂计划从该废水中回收硫酸亚铁和金属铜,设计如下流程图。

回答下列问题;
(1)A的化学式为_________,D的化学式为_______。
(2)在工业废水中加入过量A时,发应的离子方程式有:___________、__________。
(3)得到FeSO47H2O晶体的操作Ⅲ为:加热浓缩、冷却结晶、______、______、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的量的计算是中学化学的重要部分,请回答下列有关物质的量的计算问题。
(1)在标准状况下,67.2 L CO2是__________mol,质量为_______g,含有__________个CO2分子,其中含有__________mol氧原子。
(2)在标准状况下,1.7 g氨气所占的体积约为_________L,它与同条件下_____mol H2S含有相同的氢原子数。
(3)某气态氧化物化学式为RO2,在标准状况下,1.28 g该氧化物的体积是448 mL,则氧化物的摩尔质量为_______,R的相对原子质量为__________。
(4)实验室常用浓硫酸的质量分数为98%,密度为1.80 g·mL1,其物质的量浓度是_______。
(5)标准状况下,将V L A气体(摩尔质量为M g/mol)完全溶于0.1 L水(密度1 g/cm3)中,所得溶液的密度为d g/mL,则此溶液的物质的量浓度为_______mol/L。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)CH3OH(g)。按n(CO):n(H2)=1:2,向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法中,正确的是
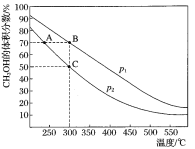
A. p1<p2
B. 该反应的ΔH>0
C. 平衡常数:K(A)=K(B)
D. 在C点时,CO转化率为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在500 mL KNO3和Cu(NO3)2的混合溶液中,c(NO3-)=6 mol/L,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
A. 电解得到的Cu的物质的量为0.5 mol
B. 向电解后的溶液中加入98 g的Cu(OH)2可恢复为原溶液
C. 原混合溶液中c(K+)=4 mol/L
D. 电解后溶液中c(H+)=2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一。
(1)电镀厂的废水中含有的CN有剧毒,需要处理加以排放。处理含CN废水的方法之一是在微生物的作用下,CN被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为__。
(2)电渗析法处理厨房垃极发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A表示乳酸根离子):
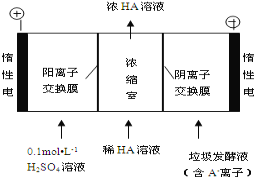
①阳极的电极反应式为___。
②简述浓缩室中得到浓乳酸的原理:__。
③电解过程中,采取一定的措施可控制阳极室的pH约为6~8,此时进入浓缩室的OH可忽略不计。400mL10g/L乳酸溶液通电一段时间后,浓度上升为145g/L(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为__L(提示:乳酸的摩尔质量为90g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O、NO和NO2等氮氧化物是空气污染物含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为___。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收。
①下列措施不能提高尾气中NO和NO2去除率的有___(填字母代号)
A.采用气、液逆流的方式吸收尾气
B.加快通入尾气的速率
C.吸收尾气过程中定补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是__(填化学式),吸收后排放的尾气中含量较高的氮氧化物是__(填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
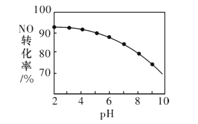
①在酸性NaClO溶液中,HC1O氧化NO生成Cl和NO3-,其离子方程式为__。
②NaClO溶液的初始pH越小,NO转化率越高,其原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯(![]() )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(![]() )、苯甲酸(
)、苯甲酸(![]() )等产品。下表列出了有关物质的部分物理性质,请回答:
)等产品。下表列出了有关物质的部分物理性质,请回答:
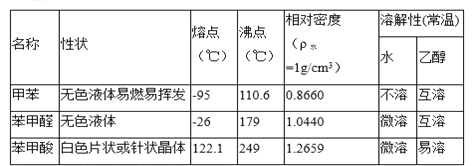
注:甲苯、苯甲醛、苯甲酸三者互溶。
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入2mL甲苯和一定量其它试剂,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。
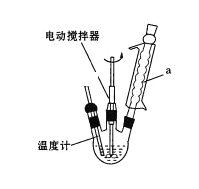
(1)装置a的主要作用是___。三颈瓶中发生反应的化学方程式为___。
(2)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是___。
(3)反应完毕,反应混合液经过自然冷却至室温后,还应经过过滤、___(填操作名称)等操作,才能得到苯甲醛粗产品。
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸。
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,依次进行的操作步骤是___(按步骤顺序填字母)。
a.对混合液进行分液
b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2
d.与适量碳酸氢钠溶液混合振荡
②若对实验①中获得的苯甲酸(相对分子质量为122)产品进行纯度测定,可称取2.500g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000mol/LKOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL。产品中苯甲酸的质量分数为__(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式不正确的是
A.醋酸钠水解的离子方程式:CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
B.乙醇在催化剂存在的条件下被氧气氧化的化学方程式:2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
C.向铜粉与稀硫酸的混合物中通热空气制硫酸铜溶液的化学方程式:2Cu+O2+2H2SO4=2CuSO4+2H2O
D.将过量CO2通入NaClO溶液的离子方程式:CO2+H2O+2ClO-=CO![]() +2HClO
+2HClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com