
【题目】甲苯(![]() )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(![]() )、苯甲酸(
)、苯甲酸(![]() )等产品。下表列出了有关物质的部分物理性质,请回答:
)等产品。下表列出了有关物质的部分物理性质,请回答:
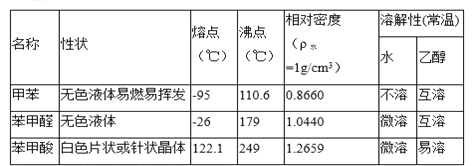
注:甲苯、苯甲醛、苯甲酸三者互溶。
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入2mL甲苯和一定量其它试剂,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。
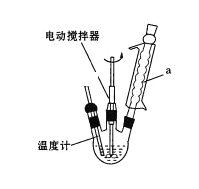
(1)装置a的主要作用是___。三颈瓶中发生反应的化学方程式为___。
(2)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是___。
(3)反应完毕,反应混合液经过自然冷却至室温后,还应经过过滤、___(填操作名称)等操作,才能得到苯甲醛粗产品。
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸。
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,依次进行的操作步骤是___(按步骤顺序填字母)。
a.对混合液进行分液
b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2
d.与适量碳酸氢钠溶液混合振荡
②若对实验①中获得的苯甲酸(相对分子质量为122)产品进行纯度测定,可称取2.500g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000mol/LKOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL。产品中苯甲酸的质量分数为__(保留一位小数)。
【答案】冷凝回流,防止甲苯的挥发而降低产品产率 ![]() +2H2O2
+2H2O2![]() +3H2O H2O2在较高温度时分解速度加快,使实际参加反应的H2O2减少影响产量 蒸馏 dacb 87.8%
+3H2O H2O2在较高温度时分解速度加快,使实际参加反应的H2O2减少影响产量 蒸馏 dacb 87.8%
【解析】
(1)根据物质的性质,得出装置a的主要作用;三颈瓶中甲苯被双氧水氧化为苯甲醛;
(2)H2O2在较高温度时分解为水和氧气的速度加快;
(3)反应完毕,过滤出固体催化剂,再根据甲苯、苯甲醛、苯甲酸的沸点不同,蒸馏可得苯甲醛粗产品;
(4)①混有苯甲酸的苯甲醛,加入适量碳酸氢钠溶液混合振荡,苯甲酸与碳酸氢钠反应生成可溶于水的苯甲酸钠,分液后,在水层中加入盐酸,苯甲酸钠与盐酸反应生成微溶于水的苯甲酸,过滤、洗涤、干燥,可得苯甲酸。
②根据消耗KOH的物质的量计算苯甲酸的质量,苯甲酸的质量分数=苯甲酸的质量÷样品质量×100%。
(1)由表中数据可知,甲苯沸点低,装置a(冷凝管)的主要作用是冷凝回流,防止甲苯的挥发而降低产品产率,三颈瓶中甲苯被双氧水氧化为苯甲醛,发生反应的化学方程式为![]() +2H2O2
+2H2O2 +3H2O,故答案为:冷凝回流,防止甲苯的挥发而降低产品产率;
+3H2O,故答案为:冷凝回流,防止甲苯的挥发而降低产品产率;![]() +2H2O2
+2H2O2![]() +3H2O;
+3H2O;
(2)H2O2在较高温度时分解为水和氧气的速度加快,使实际参加反应的H2O2减少影响产量,所以温度过高时,苯甲醛的产量有所减少,故答案为:H2O2在较高温度时分解速度加快,使实际参加反应的H2O2减少影响产量;
(3)反应完毕,过滤出固体催化剂,再根据甲苯、苯甲醛、苯甲酸的沸点不同,蒸馏可得苯甲醛粗产品,所以操作名称是过滤、蒸馏,故答案为:蒸馏;
(4)①混有苯甲酸的苯甲醛,加入适量碳酸氢钠溶液混合振荡,苯甲酸与碳酸氢钠反应生成可溶于水的苯甲酸钠,分液后,在水层中加入盐酸,苯甲酸钠与盐酸反应生成微溶于水的苯甲酸,过滤、洗涤、干燥,可得苯甲酸,则正确的实验步骤是dacb,故答案为:dacb;
②18.0mL 0.1mol/LKOH溶液中氢氧化钾的物质的量是0.018L×0.1mol/L =0.0018mol,根据![]() ,可知20.0mL乙醇溶液中含苯甲酸的物质的量是0.0018mol,则产品中苯甲酸的质量分数为
,可知20.0mL乙醇溶液中含苯甲酸的物质的量是0.0018mol,则产品中苯甲酸的质量分数为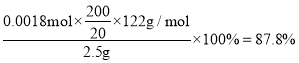 ,故答案为:87.8%。
,故答案为:87.8%。


科目:高中化学 来源: 题型:
【题目】某无色混合物水溶液,可能含有以下离子中的若干种:K+、NH4+、Mg2+、Cu2+、Cl-、CO32-、SO42-,现各取 100mL 溶液三份进行如下实验:①向第一份加入 AgNO3 溶液,有白色沉淀产生;②向第二份加入足量 NaOH 溶液后加热,收集到气体 0.896L(标准状况)③向第三份加入足量 BaCl2 溶液,得到沉淀 6.63 克,经足量盐酸洗涤后,剩余 4.66 克。 试回答下列问题:
(1)肯定存在的离子有__________,肯定不存在的离子有__________;
(2)可能存在的离子是__________,判断该离子存在与否的方法是__________;
(3)肯定存在的阳离子在原溶液中的物质的量浓度__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据题意,选择恰当的选项用字母代号或文字填空。
(1)中国的高铁技术居于国际领先地位。
①高铁座椅内填充有聚氨酯软质泡沫。聚氨酯属于___(填字母代号,下同)。
a.金属材料 b.无机非金属材料 c.有机高分子材料
②高铁信息传输系统中使用了光导纤维。光导纤维的主要成分是___。
a.铜 b.石墨 c.二氧化硅
③高铁轨道建设需用大量水泥。生产水泥的主要原料为黏土和___。
a.石灰石 b.粗盐 c.纯碱
④高铁轨道建设铺设的铁轨属于___(填“金属铁”或“铁合金”)。
(2)煤炭在我国能源结构中占有重要地位,合理使用有利于社会可持续发展。
①控制燃煤产生的___(填化学式)排放,能够减少硫酸型酸雨的形成。
②煤的气化和液化是实现能源清洁化的重要途径。水煤气中CO和H2在加热、加压和催化剂存在条件下可以合成液体燃料(CH3OH),该反应的化学方程式为___。煤的干馏属于__(填“化学变化”或“物理变化”)。
(3)营养均衡有利于身体健康。
①人体内提供能量的主要营养物质为___、糖类和蛋白质。
②维生素是人体需要的营养物质。如图为某品牌维生素C泡腾片说明书的部分内容。该泡腾片中添加的着色剂是___。

③泡腾片溶于水时产生“沸腾”效果,是由于添加的酒石酸和___(填物质名称)反应释放出了气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此,下列说法正确的是

A.该硫酸的物质的量浓度为9.2mol·L-1
B.该硫酸与等体积的水混合所得溶液的质量分数小于49%
C.配制200mL4.6mol·L-1的稀硫酸需取该硫酸50.0mL
D.该硫酸50.0mL与足量的铜反应可得到标准状况下SO2气体10.304L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产与人类进步紧密相联。下列有关说法不正确的是
A. 空气吹出法提取海水中溴通常使用SO2作还原剂
B. 侯氏制碱法工艺流程中利用了物质溶解度的差异
C. 合成氨采用高温、高压和催化剂主要是提高氢气平衡转化率
D. 工业用乙烯直接氧化法制环氧乙烷体现绿色化学和原子经济
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三乙酸锰可作单电子氧化剂,用如下反应可以制取三乙酸锰:4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40CH3COOH。
(1)基态锰原子的价层电子排布式为___。
(2)CH3COOH中碳原子的杂化形式为___。
(3)NO3-的空间构型是___,与NO3-互为等电子体的分子的化学式为___(任写一种)。
(4)某种镁铝合金可作为储钠材料,该合金晶胞结构如图所示,晶胞棱长为anm,晶体中每个镁原子周围距离最近的铝原子数目为___,该晶体的密度为___g/cm3(阿伏伽德罗常数的数值用NA表示)。
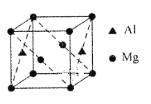
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异丁烯(![]() )是重要的化工原料,主要用于制备丁基橡胶、聚异丁烯塑料等。下列关于异丁烯的说法错误的是( )
)是重要的化工原料,主要用于制备丁基橡胶、聚异丁烯塑料等。下列关于异丁烯的说法错误的是( )
A.异丁烯发生加聚反应生成聚异丁烯
B.异丁烯在一定条件下可以和氢气发生加成反应,加成产物的二氯代物有3种
C.异丁烯与HCl在一定条件下能发生加成反应且只能得到一种加成产物
D.异丁烯和环丁烷(![]() )互为同分异构体
)互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg-Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应。向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如下图。回答下列问题:

(1)写出OA段和BC段反应的离子方程式:
OA:___________ ; BC:_____________;
(2)原Mg-Al合金的质量是_____________。
(3)原HCl溶液的物质的量浓度是________________。
(4)所加NaOH溶液的物质的量浓度是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向![]() 盐酸中滴加
盐酸中滴加![]() 溶液,溶液的pH随
溶液,溶液的pH随![]() 溶液体积的变化如图。已知
溶液体积的变化如图。已知![]() 。下列说法不正确的是( )
。下列说法不正确的是( )
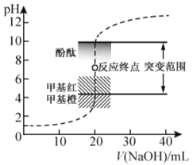
A.![]() 与盐酸恰好完全反应时,
与盐酸恰好完全反应时,![]()
B.选择变色范围在pH突变范围内的指示剂,可减小实验误差
C.选择甲基红指示反应终点,误差比甲基橙的大
D.![]() 时,
时,![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com