
【题目】三乙酸锰可作单电子氧化剂,用如下反应可以制取三乙酸锰:4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40CH3COOH。
(1)基态锰原子的价层电子排布式为___。
(2)CH3COOH中碳原子的杂化形式为___。
(3)NO3-的空间构型是___,与NO3-互为等电子体的分子的化学式为___(任写一种)。
(4)某种镁铝合金可作为储钠材料,该合金晶胞结构如图所示,晶胞棱长为anm,晶体中每个镁原子周围距离最近的铝原子数目为___,该晶体的密度为___g/cm3(阿伏伽德罗常数的数值用NA表示)。
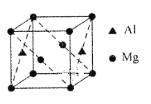
【答案】3d54s2 sp3和sp2 平面三角形 BF3或BCl3 4 ![]()
【解析】
(1)锰为25号元素,基态锰原子的价层电子为其3d、4s能级上的电子;
(2)CH3COOH中甲基上C原子价层电子对个数是4、羧基上C原子价层电子对个数是3,根据价层电子对互斥理论判断碳原子的杂化形式;
(3)根据价层电子对个数=σ键个数+孤电子对个数,判断NO3-离子的空间构型,与NO3-互为等电子体的分子中含有4个原子、价电子数是24;
(4)根据晶胞结构判断晶体中每个镁原子周围距离最近的铝原子数目;根据晶体的密度=![]() 计算。
计算。
(1)锰为25号元素,价层电子为其3d、4s能级上的电子,基态锰原子的价层电子排布式为3d54s2 ,故答案为:3d54s2;
(2) CH3COOH中甲基上的碳原子含有4个σ键,没有孤电子对,采用sp3杂化,羧基上的碳原子含有3个σ键,没有孤电子对,采用sp2杂化,故答案为:sp3和sp2;
(3)NO3一中氮原子价层电子对数为3+![]() =3,N原子轨道的杂化类型为sp2,空间构型为平面三角形,NO3-中有4个原子,5+6×3+1=24个价电子,SO3中有4个原子,6+6×3=24个价电子,与NO3-是等电子体,BF3、BCl3等也与硝酸根离子为等电子体,故答案为:平面三角形;SO3或BF3、BCl3等;
=3,N原子轨道的杂化类型为sp2,空间构型为平面三角形,NO3-中有4个原子,5+6×3+1=24个价电子,SO3中有4个原子,6+6×3=24个价电子,与NO3-是等电子体,BF3、BCl3等也与硝酸根离子为等电子体,故答案为:平面三角形;SO3或BF3、BCl3等;
(4)在晶胞中,镁原子位于顶点和2个面的面心,铝原子位于2个面的面心,每个镁原子周围距离最近的铝原子数目为4个,距离均为面对角线长度的一半;晶胞棱长为anm,则晶胞体积=(a×10-7)3cm3,晶胞的质量=![]() g=
g=![]() g,则晶胞的密度=
g,则晶胞的密度=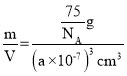
![]()
=![]() g/cm3,故答案为:4;
g/cm3,故答案为:4;![]() 。
。


科目:高中化学 来源: 题型:
【题目】实验室通常用无水乙醇和浓硫酸加热到170℃制取乙烯,反应方程式为:CH3CH2OH![]() CH2=CH2↑+H2O。若温度过高或加热时间过长,制得的乙烯往往混有CO2、SO2、H2O(g)。
CH2=CH2↑+H2O。若温度过高或加热时间过长,制得的乙烯往往混有CO2、SO2、H2O(g)。
(1)试用下图所示的装置设计一个实验,验证制得的气体中含有杂质气体:二氧化碳,二氧化硫和水蒸气,按气流的方向,各装置的连接顺序是 。

(2)实验时若观察到:①中A瓶中溶液褪色,B瓶中溶液颜色逐渐变浅,C瓶中溶液不褪色,则B瓶的作用是 ,C瓶的作用是 。
(3)若气体通过装置③中所盛溶液时,产生白色沉淀,它可以用来验证的气体是____。
(4)装置②中所加的试剂名称是____ _______。
(5)乙烯在一定条件下能制得聚乙烯,写出相应的化学反应方程式: 。
(6)某同学做此实验时发现装置④存在的不妥之处是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施之一。
(1)电镀厂的废水中含有的CN有剧毒,需要处理加以排放。处理含CN废水的方法之一是在微生物的作用下,CN被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为__。
(2)电渗析法处理厨房垃极发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A表示乳酸根离子):
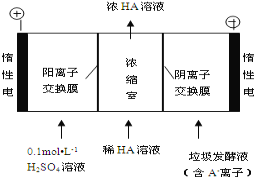
①阳极的电极反应式为___。
②简述浓缩室中得到浓乳酸的原理:__。
③电解过程中,采取一定的措施可控制阳极室的pH约为6~8,此时进入浓缩室的OH可忽略不计。400mL10g/L乳酸溶液通电一段时间后,浓度上升为145g/L(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为__L(提示:乳酸的摩尔质量为90g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质N2、H2O、Na2O2、CaCl2、KOH、NaF中,既含有离了键,又含有共价键的物质是__________,属于共价化合物的是__________。
(2)用电子式表示CaCl2的形成过程:____________________。
(3)氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用产生NH3。请写出Na3N的电子式是__________。
(4)Na3N与盐酸反应生成两种盐,反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯(![]() )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(![]() )、苯甲酸(
)、苯甲酸(![]() )等产品。下表列出了有关物质的部分物理性质,请回答:
)等产品。下表列出了有关物质的部分物理性质,请回答:
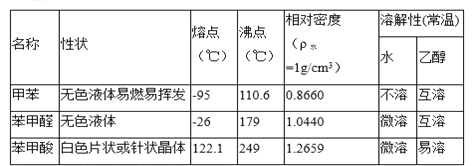
注:甲苯、苯甲醛、苯甲酸三者互溶。
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入2mL甲苯和一定量其它试剂,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。
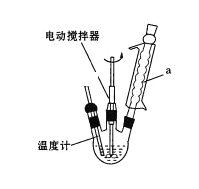
(1)装置a的主要作用是___。三颈瓶中发生反应的化学方程式为___。
(2)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是___。
(3)反应完毕,反应混合液经过自然冷却至室温后,还应经过过滤、___(填操作名称)等操作,才能得到苯甲醛粗产品。
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸。
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,依次进行的操作步骤是___(按步骤顺序填字母)。
a.对混合液进行分液
b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2
d.与适量碳酸氢钠溶液混合振荡
②若对实验①中获得的苯甲酸(相对分子质量为122)产品进行纯度测定,可称取2.500g产品,溶于200mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000mol/LKOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL。产品中苯甲酸的质量分数为__(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下,在CH3COONa稀溶液中分别加入少量下列物质:
①固体NaOH;②固体KOH;③固体NaHSO4;④固体CH3COONa;⑤冰醋酸
其中一定可使c(CH3COO-)/c(Na+)比值增大的是 ( )
A. ①② B. ②⑤ C. ①⑤ D. ②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物M结构简式为![]() ,其合成线路如下:
,其合成线路如下:
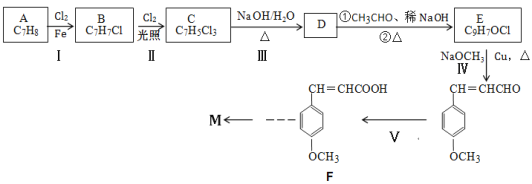
已知①通常在同一个碳原子上连有两个羟基不稳定,易脱水成羰基,即 +H2O
+H2O
②R1CHO+R2CH2CHO![]() +H2O
+H2O
试回答下列问题:
(1)A的1H-NMR谱(核磁共振氢谱)中显示吸收峰的数目为___,有机物M中含氧官能团的名称是___,C的结构简式____。
(2)D→E的转化过程中第①步反应的化学方程式为___。
(3)Ⅳ的反应类型为___,“Ⅴ”包含两步反应,其中第一步反应的试剂、条件是___。
(4)A也是合成阿斯匹林(![]() )的原料,
)的原料,![]() 有多种同分异构体,写出符合下列条件的同分异构体的结构简式___(任写一种)。
有多种同分异构体,写出符合下列条件的同分异构体的结构简式___(任写一种)。
①苯环上有3个取代基;
②仅属于酯类,能发生银镜反应,且1mol该物质反应时最多能生成4molAg;
③苯环上的一氯代物有2种。
(5)若以F和乙醛为原料来合成化合物M(![]() ),试写出合成路线____。
),试写出合成路线____。
(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.强酸、强碱、重金属盐等可使蛋白质变性
B.用新制氢氧化铜悬浊液(必要时可加热)能鉴别甲酸、乙醇、乙醛
C.乙酸乙酯中混有的乙酸,可加入足量的饱和![]() 溶液,经分液除去
溶液,经分液除去
D.向苯和苯酚的混合液中加入浓溴水,充分反应后过滤,可除去苯中少量的苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中,只含有下表中所示的四种离子,试推测X离子及其个数b可能为:( )
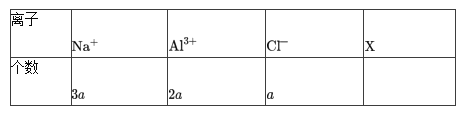
A.SO42- 8aB.OH- 8aC.NO3- 4aD.SO42- 4a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com