
【题目】实验室需要 0.5mol/L的硫酸溶液500mL。根据溶液的配制情况回答下列问题。
(1)根据计算得知,需量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为________mL。
(2)在如图所示仪器中,配制上述溶液肯定不需要的有_________(填序号)
A.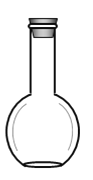 B.
B. C.
C.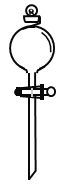 D.
D.![]()
(3)实验操作步骤为:
A.把制得的溶液小心地转移至容量瓶中。
B.量取所需浓硫酸 ,在烧杯中用适量的蒸馏水将它稀释并冷却至室温。
C.继续向容量瓶中加蒸馏水至液面距刻度1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切。
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡。
E.将容量瓶塞塞紧,充分摇匀。
操作步骤的正确顺序为_______(填序号)。
(4)下列情况中,会使所配溶液浓度偏高的是_______(填序号)。
A.量取所需浓硫酸某同学观察液面时仰视
B.没有进行上述的操作步骤D
C.加蒸馏水时,不慎超过了刻度线
D.容量瓶使用前内壁沾有水珠
E.用少量蒸馏水洗涤量取浓硫酸后的量筒,洗涤的液体注入容量瓶
【答案】13.6 C BADCE AE
【解析】
(1)先求出质量分数为98%、密度为1.84g/cm3的浓硫酸的物质的量浓度,再根据稀释定律求出配制0.5mol/L的硫酸溶液500mL需要的浓硫酸的体积。
(2)配制一定物质的量浓度溶液需要用到容量瓶、量筒、胶头滴管、烧杯、玻璃棒,不需要用分液漏斗。
(3)根据配制一定物质的量浓度的溶液的实验操作步骤排序。
(4)根据c=![]() ,若n偏大或V偏小,都会使所配溶液浓度偏高,据此分析。
,若n偏大或V偏小,都会使所配溶液浓度偏高,据此分析。
(1)质量分数为98%、密度为1.84g/cm3的浓硫酸的物质的量浓度为c=![]() =
=![]() mol/L=18.4mol/L,配制0.5mol/L的硫酸溶液500mL,根据稀释前后溶质的物质的量不变,需要的浓硫酸的体积为
mol/L=18.4mol/L,配制0.5mol/L的硫酸溶液500mL,根据稀释前后溶质的物质的量不变,需要的浓硫酸的体积为![]() =13.6mL。
=13.6mL。
(2)用浓硫酸配制稀硫酸,需要用量筒量取浓硫酸的体积,倒入盛水的烧杯中,同时用玻璃棒搅拌,然后用玻璃棒引流把稀释并冷却的硫酸溶液转移到容量瓶中,最后还要用胶头滴管定容。所以在图示仪器中,用到的是ABD,不需要用分液漏斗,故选C。
(3) 用浓硫酸配制稀硫酸,先计算需要量取的浓硫酸的体积,然后量取所需浓硫酸,在烧杯中用适量的蒸馏水将它稀释并冷却至室温,把制得的溶液小心地转移至容量瓶中,用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡,继续向容量瓶中加蒸馏水至液面距刻度1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切,将容量瓶塞塞紧,充分摇匀。故操作步骤的正确顺序为BADCE。
(4) A.量取所需浓硫酸观察液面时仰视,量取的浓硫酸多于13.6mL,溶质的量偏大,导致所配溶液浓度偏高;
B.没有洗涤烧杯和玻璃棒,导致溶质的量偏小,所配溶液浓度偏低;
C.加蒸馏水时,不慎超过了刻度线,使溶液体积偏大,所配溶液浓度偏低;
D.容量瓶使用前内壁沾有水珠,对溶质的物质的量和溶液体积都没有影响,对所配溶液浓度无影响;
E.用少量蒸馏水洗涤量取浓硫酸后的量筒,洗涤的液体注入容量瓶,使溶质的量偏大,所配溶液浓度偏高;
故选AE。


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】甲烷是一种清洁能源,下列有关说法正确的是( )
A.一定温度下,反应CO2(g)+4H2(g)=CH4(g)+2H2O(g)能自发进行,该反应的ΔH>0
B.碱性甲烷-空气燃料电池的负极反应为CH4-8e-+10OH-=CO![]() +7H2O
+7H2O
C.标准状况下,5.6LCH4在空气中完全燃烧,转移电子的数目约为2.408×1024
D.甲烷和微生物共同作用可以实现城市废水脱氮处理,反应温度越高,脱氮速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向7.5mL0.03molL-1的H3PO4溶液中,逐滴加入相同浓度的NaOH溶液,溶液pH与NaOH溶液体积关系如图所示,已知Ka1>Ka2>Ka3,下列说法错误的是
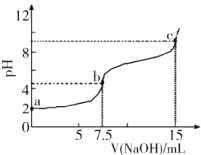
A.H3PO4第一级电离平衡常数Ka1的数量级为10-3
B.水的电离程度:b<c
C.b点溶液中离子浓度:c(Na+)>c(![]() )>c(
)>c(![]() )>c(
)>c(![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D.c点溶液中:2c(H3PO4)+c(![]() )+c(H+)=c(OH-)+c(
)+c(H+)=c(OH-)+c(![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据vt图分析外界条件改变对可逆反应A(g)+3B(g) ![]() 2C(g) ΔH<0的影响。该反应的速率与时间的关系如图所示:
2C(g) ΔH<0的影响。该反应的速率与时间的关系如图所示:
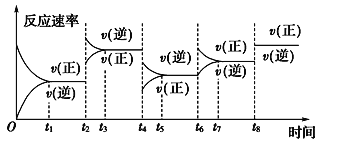
可见在t1、t3、t5、t7时反应都达到平衡,如果t2、t4、t6、t8时都只改变了一个反应条件,则下列对t2、t4、t6、t8时改变条件的判断正确的是
A. 使用了催化剂、增大压强、减小反应物浓度、降低温度
B. 升高温度、减小压强、减小反应物浓度、使用了催化剂
C. 增大反应物浓度、使用了催化剂、减小压强、升高温度
D. 升高温度、减小压强、增大反应物浓度、使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R为短周期元素,其原子半径和最外层电子数之间的关系如图所示。下列说法错误的是
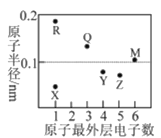
A.R不能把Q从其盐溶液中置换出来
B.X、R、Q三种元素可以构成离子化合物
C.热稳定性:ZX3<YX4
D.X2M的水溶液露置于空气中易变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01mol/L的KCl、K2C2O4溶液,所得的沉淀溶解平衡图象如图所示(不考虑![]() 的水解,pAg=
的水解,pAg=![]() lgc(Ag+)),下列说法正确的是
lgc(Ag+)),下列说法正确的是
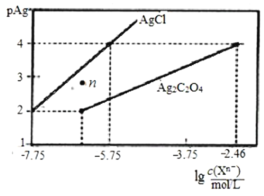
A.KspAg2C2O4的数量级等于10-10
B.n点表示AgCl的过饱和溶液
C.向c(Cl-)=c(![]() )的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D.Ag2C2O4+2Cl-![]() 2AgCl+
2AgCl+![]() 的平衡常数为103.29
的平衡常数为103.29
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】麻黄素M是拟交感神经药。合成M的一种路线如图所示:
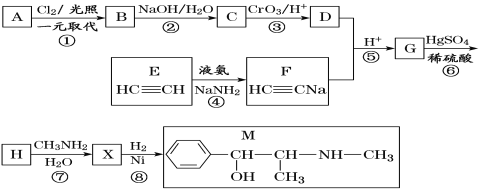
已知:I.R—CH2OH![]() RCHO
RCHO
II.R1-CHO+R-C≡CNa![]()
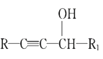
IV.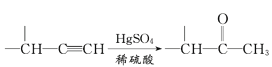
V.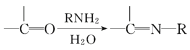
请回答下列问题:
(1)D的名称是_______;G中含氧官能团的名称是_______。
(2)反应②的反应类型为_______;A的结构简式为_______。
(3)写出反应⑦的化学方程式:______________________________。
(4)X分子中最多有_______个碳原子共平面。
(5)在H的同分异构体中,同时能发生水解反应和银镜反应的芳香族化合物中,核磁共振氢谱上有4组峰,且峰面积之比为1∶1∶2∶6的有机物的结构简式为_________________。
(6)已知:![]() 仿照上述流程,设计以苯、乙醛为主要原料合成某药物中间体
仿照上述流程,设计以苯、乙醛为主要原料合成某药物中间体![]() 的路线________________。
的路线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按照课本实验要求,用50mL0.50mol/L的盐酸于50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热,下列说法中,正确的是( )
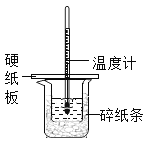
A. 烧杯间填满碎纸条的作用是固定小烧杯
B. 用如图装置可以完成中和热测定的实验
C. 为防止混合溶液时溅出产生误差,因此混合时速度要慢
D. 若将盐酸体积改为60mL,不考虑热量损失,理论上所求中和热相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙基叔丁基酸(以ETBE表示)是一种性能优良的高辛烷值汽油调和剂,用乙醇与异丁烯(以IB表示)在催化剂HZSM-5催化下合成ETBE,反应的化学方程式为:C2H5OH(g)+IB(g)![]() ETBE(g) △H,回答下列问题:
ETBE(g) △H,回答下列问题:
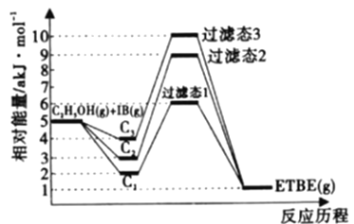
注:C1表示乙醇和异丁烯同时吸附,C2表示先吸附乙醇,C3表示先吸附异丁烯。
(1)反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如上图所示,该反应的△H=____akJ·mol-1,下列选项正确的是______(填序号)。
A.反应历程的最优途径是C1
B.HZSM-5没有参加化学反应
C.相同条件下,采用不同途径时,乙醇的平衡转化率C1>C2>C3
D.升高反应温度有利于提高平衡产率
(2)向刚性容器中按物质的量之比1:1充入乙醇和异丁烯,在温度为378 K与388 K时异丁烯的转化率随时间变化如图所示。
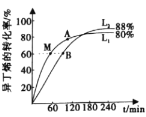
①图中A、M、B三点,化学反应速率由大到小的顺序为______,其中逆反应速率最大的点是______(用符号A、M、B填写)。
②388 K时,容器内起始总压为P0 Pa,用分压表示的该反应的平衡常数K=______Pa-1(用含有P0的式子表示)。
③瑞典化学家阿累尼乌斯的化学反应速率经验定律为:![]() ,(其中,k为速率常数,A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数,约为2.718)。由此判断下列说法中正确的是_____(填序号,k正 、k逆为正、逆速率常数)。
,(其中,k为速率常数,A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数,约为2.718)。由此判断下列说法中正确的是_____(填序号,k正 、k逆为正、逆速率常数)。
A.其他条件不变,升高温度,k正增大,k逆变小
B.其他条件不变,使用催化剂,k正、k逆同倍数增大
C.其他条件不变,増大反应物浓度k正增大,k逆不变
D.其他条件不变,减小压强,k正、k逆都变小
已知反应速率υ=υ正-υ逆=k正P(C2H5OH)·P(IB)-k逆P(ETBE),计算上图中M点![]() =_______(保留两位小数)
=_______(保留两位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com