
【题目】下列有关物质分类或归类正确的一组是( )
A. 漂白粉是化合物 B. 水玻璃是纯净物
C. 盐酸是电解质 D. 纯碱不属于碱
科目:高中化学 来源: 题型:
【题目】(CN)2、(OCN)2等被称为拟卤素,(CN)2在一定条件下氢化可以得到乙二胺(H2NCH2CH2NH2)。回答下列问题:
(1)Fe4[Fe(CN)6]3是较早发现的CN-配合物,其中铁元素呈现两种不同的价态。写出外界离子基态核外电子排布式:________________。
(2)与OCN-互为等电子体的分子为________(填分子式)。
(3)1 mol(CN)2中含有π键的数目为________。
(4)乙二胺中C原子的轨道杂化方式为________。
(5)乙二胺易溶于水,除因为是极性分子外,还可能的原因为________。
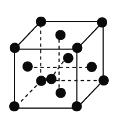
(6)含CN-的配合物常用于冶炼黄金。金的晶胞结构如下图所示,晶体中每个Au原子周围紧邻且等距的Au原子有________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,反应![]() 达到反应限度的标志是:
达到反应限度的标志是:
A. 正、逆反应速率相等且都等于零
B. c(A2):c(B2):c(AB)= 1:1:2
C. A2、B2和AB的物质的量不再改变
D. 单位时间内消耗n molA2的同时生成2nmolAB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机玻璃是由有机物X加聚制得的热塑性塑料,为透明如玻璃状的无色固体,可用以制造航空窗玻璃、仪表盘、外科照明灯、装饰品和生活用品等.其结构简式为: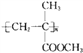 请回答下列问题:
请回答下列问题:
(1)写出X的结构简式_____________________;
(2)有机物X不能发生的反应有________(填写序号);
①和氢气加成 ②使溴水褪色 ③被酸性高锰酸钾溶液氧化 ④水解反应 ⑤酯化反应
(3)有机物X有多种同分异构体,其中含有2个甲基且属于羧酸类的有机分子的结构简式为________________________________(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表达下列反应的离子方程式为
A. 用醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O
B. 硫化亚铁与浓硫酸混合加热:2H++FeS=H2S↑+ Fe2+
C. 向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3![]() =Al2(CO3)3↓
=Al2(CO3)3↓
D. 用氢氧化钠溶液吸收工业废气中的NO2:2NO2+2OH-=![]() +
+![]() + H2O
+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是熔点最高的金属,是重要的战略物资。自然界中钨主要存在于黑钨矿中,其主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、As的化合物。由黑钨矿冶炼钨的工艺流程如下:
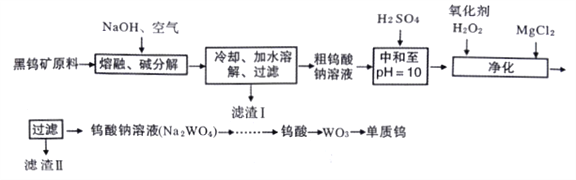
已知:
①滤渣I的主要成份是Fe2O3、MnO2。
②上述流程中,钨的化合价只有在最后一步发生改变。
③常温下钨酸难溶于水。
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为____,请写出MnWO4在熔融条件下发生碱分解反应生成Fe2O3的化学方程式__________。
(2)上述流程中向粗钨酸钠溶液中加硫酸中和至pH=10后,溶液中的杂质阴离子确SiO32-、HAsO32-、HAsO42-等,则“净化”过程中,加入H2O2时发生反应的离子方程式为____,滤渣Ⅱ的主要成分是____。
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。下图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线,则:
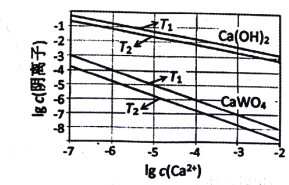
①T1 _____T2(填“>”或“<”)T1时Ksp(CaWO4)=____。
②将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
A. K=![]()
B. K=![]()
C. 增大c(H2O)或减小c(H2),会使该反应平衡常数减小
D. 改变反应的温度,平衡常数不一定变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2的漂白能力是漂白粉的4~5倍, NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:
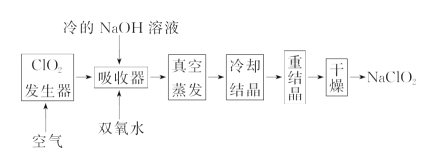
(1)ClO2气体发生器中的反应为:2NaClO3+SO2+H2SO4===2ClO2+2NaHSO4。实际工业生产中,可用硫黄、浓硫酸代替原料中的SO2,其原因为____________(用化学方程式表示)。
(2)反应结束后,向ClO2发生器中通入一定量空气的目的:________________________。
(3)吸收器中生成NaClO2的离子反应方程式为________________________________。
(4)CO和联氨(N2H4)的性质及应用的研究是能源开发、环境保护的重要课题。
①用CO、O2和KOH溶液可以制成碱性燃料电池,则该电池反应的离子方程式为_______________。
②用CO、O2和固体电解质还可以制成如下图所示的燃料电池,则电极d的电极反应式为__________。
(5)联氨的性质类似于氨气,将联氨通入CuO浊液中,有关物质的转化如图所示。
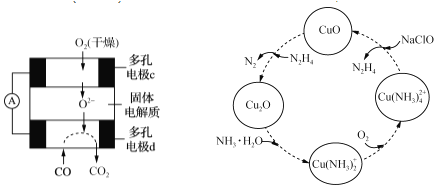
①在转化过程中通入氧气发生反应后,溶液的pH将________(填“增大”、“减小”或“不变”)。转化中当有1 mol N2H4参与反应时,需要消耗O2的物质的量为________。
②加入NaClO时发生的反应为:
Cu(NH3)42++2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
该反应需在80℃以上进行,其目的除了加快反应速率外,还有_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下物质间的每步转化通过一步反应能实现的是( )
A. Al-Al2O3-Al(OH)3-NaAlO2 B. Si-SiO2-H2SiO3-Na2SiO3
C. Cu-CuO-Cu(OH)2-CuSO4 D. Na-Na2O2-Na2CO3-NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com