
| A、室温下,1L pH=1的盐酸中,由水电离的H+离子数目为0.1NA |
| B、标况下,11.2L SO3所含的分子数目为0.5NA |
| C、甲烷碱性燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为4NA |
| D、1 mol C2H6O分子中含有的O-H键数目一定为NA |


科目:高中化学 来源: 题型:
| A、胆矾是电解质、液氨是非电解质 |
| B、淀粉溶液、硅酸、氯化铁溶液均为胶体 |
| C、淀粉、纤维素、油脂都属于天然高分子化合物 |
| D、SO3、SiO2、NO2均为酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应属于氧化还原反应 |
| B、此反应中只有砷元素被氧化,只有氮元素被还原 |
| C、HNO3、H2O是反应物,H2SO4、NO、H3AsO4是生成物 |
| D、HNO3、H2SO4、H3AsO4都是最高价氧化物对应的水化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HClO可以使有色物质漂白,所以具有氧化性物质可作漂白剂 |
| B、Na的金属活动性比Mg强,故可用Na与MgCl2溶液反应制Mg |
| C、浓硝酸中的HNO3,见光会分解,故有时在实验室看到的浓硝酸呈黄色 |
| D、因为SO2具有较强还原性,所以不能用浓硫酸来干燥它 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、①④ |
| C、①③④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
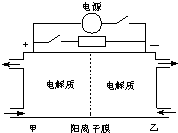 如图是一种蓄电池的示意图,被膜隔开的电解质分别为Na2S2和NaBr3.放电后变为Na2S4和NaBr下面对该装置工作过程中叙述正确的是( )
如图是一种蓄电池的示意图,被膜隔开的电解质分别为Na2S2和NaBr3.放电后变为Na2S4和NaBr下面对该装置工作过程中叙述正确的是( )| A、放电过程,甲电极电极反应:2S22--2e-=S42- |
| B、放电过程,电池反应:2S22-+Br3-=S42-+3Br- |
| C、充电过程,阳极室流出NaBr3溶液 |
| D、充电后向阳极室补充Na2S4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com