
����Ŀ����1����֪�� C(s)+O2(g)===CO2(g) ��H1����393.5 kJ/mol
C(s)+H2O(g)===CO(g)+H2(g) ��H2����131.3 kJ/mol
��ӦCO(g)+H2(g) +O2(g)===H2O(g)+CO2(g)����H= _____________kJ/mol��
��2����һ���ݵ��ܱ������У���CO��H2�ϳɼ״���CO(g)+2H2(g)![]() CH3OH(g) ��H
CH3OH(g) ��H
��������������˵���÷�Ӧ�Ѵﵽƽ��״̬����_________(�����)��
A��ÿ����1 mol CO��ͬʱ����2molH2
B��������������ʵ�������
C������CH3OH������������CO���������
D��CH3OH��CO��H2��Ũ�ȶ����ٷ����仯
��CO��ƽ��ת����(��)���¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��A��B�����ƽ�ⳣ��KA_______KB(������������=����������,��ͬ)����ͼ�ж���H ______0��
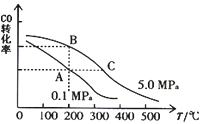
��3��ij�¶��£���2.0 mol CO��6.0 molH2����2 L���ܱ������У���ַ�Ӧ�ﵽƽ��ʱ���c(CO)=0.25 mol/L������¶��µ�ƽ�ⳣ��K=_________(������λ��Ч����)��
���𰸡�-524.8 C = < 1.3
��������
��1�����ݸ�˹���ɼ���CO(g)+H2(g) +O2(g)===H2O(g)+CO2(g)����H��
��2���ٸ���ƽ���־�жϣ���ƽ�ⳣ��ֻ���¶��йأ�����ͼʾ�����¶����ߣ�COת���ʼ�С��
��3������������ʽ������ƽ�ⳣ����
��1����C(s)+O2(g)===CO2(g) ��H1����393.5 kJ/mol
��C(s)+H2O(g)===CO(g)+H2(g) ��H2����131.3 kJ/mol
���ݸ�˹���ɢ٣��ڵ�CO(g)+H2(g) +O2(g)===H2O(g)+CO2(g)����H=��393.5 kJ/mol��131.3 kJ/mol=-524.8 kJ/mol��
��2����A��ÿ����1 mol CO��ͬʱ����2molH2��˵�����淴Ӧ������ȣ���Ӧһ���ﵽƽ��״̬���ʲ�ѡA��
B��CO(g)+2H2(g)![]() CH3OH(g)����Ӧ����ϵ���ͼ�С�������ʵ����DZ�����������������ʵ������䣬һ���ﵽƽ��״̬���ʲ�ѡB��
CH3OH(g)����Ӧ����ϵ���ͼ�С�������ʵ����DZ�����������������ʵ������䣬һ���ﵽƽ��״̬���ʲ�ѡB��
C������CH3OH������������CO��������ȣ�����˵�����淴Ӧ������ȣ���һ��ƽ�⣬��ѡC��
D�����ݻ�ѧƽ�ⶨ�壬CH3OH��CO��H2��Ũ�ȶ����ٷ����仯��һ���ﵽƽ��״̬���ʲ�ѡD��
��ƽ�ⳣ��ֻ���¶��йأ�A��B������¶���ͬ������ƽ�ⳣ����ȣ�KA=KB������ͼʾ�����¶����ߣ�COת���ʼ�С��������H <0��
��3��
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
��ʼ 1 3 0
ת�� 0.75 1.5 0.75
ƽ�� 0.25 1.5 0.75
![]() 1.3��
1.3��


 ��������ϵ�д�
��������ϵ�д� ��ӡ�Ļ���ʱ����ϵ�д�
��ӡ�Ļ���ʱ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ������ɺ�������������������̼��ص��о�ȡ��ͻ���Խ�չ���õ�ص��ܷ�ӦʽΪ4Na+3CO2![]() 2Na2CO3+C���乤��ԭ����ͼ��ʾ(�ŵ�ʱ������Na2CO3����������̼������)��
2Na2CO3+C���乤��ԭ����ͼ��ʾ(�ŵ�ʱ������Na2CO3����������̼������)��
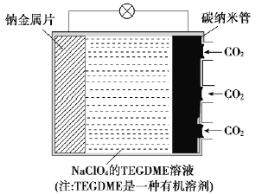
��1���ƽ���Ƭ��Ϊ�õ�ص�___��(��������������������ͬ)���ŵ�ʱ���������Һ��Na����___������___�����ƶ���
��2�����ʱ��̼��������ֱ����Դ��___�����缫��ӦʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH3��O2��һ�������·�����Ӧ��4NH3(g)��3O2(g) ![]() 2N2(g)��6H2O(g)������һ�ݻ������2 L�ܱ������г���4 mol NH3��3 mol O2��4 min��Ӧ�ﵽƽ�⣬������ɵ�H2O(g)ռ��������������40%�������б�ʾ�Ĵ˶�ʱ���ڸ÷�Ӧ��ƽ�����ʲ���ȷ����(����)
2N2(g)��6H2O(g)������һ�ݻ������2 L�ܱ������г���4 mol NH3��3 mol O2��4 min��Ӧ�ﵽƽ�⣬������ɵ�H2O(g)ռ��������������40%�������б�ʾ�Ĵ˶�ʱ���ڸ÷�Ӧ��ƽ�����ʲ���ȷ����(����)
A. v(N2)��0.125 mol��L��1��min��1B. v(H2O)��0.375 mol��L��1��min��1
C. v(O2)��0.225 mol��L��1��min��1D. v(NH3)��0.25 mol��L��1��min��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����ˮ�д��ڵ�ƽ�⣺H2O ![]() H�� + OH��������������ȷ����
H�� + OH��������������ȷ����
A. ��ˮ���ȣ�Kw����pH����
B. ����ϡ���ᣬƽ�������ƶ���c(H+)����
C. ��������������Һ��ƽ�������ƶ���Kw��С
D. ������������CH3COONa��ƽ�������ƶ���c(H��)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������һδ֪Ũ�ȵĴ��ᣬijѧ����0.1000 mol��L-1 NaOH����Һ���вⶨ�����Ũ�ȵ�ʵ�飬ȡ20.00mL������������ƿ�У����μ�2~3��ָʾ������NaOH����Һ���еζ����ظ������ζ�����2~3�Σ���¼�������¡����������գ�
ʵ���� | �����������/mL | NaOH��Һ��Ũ��/mol��L-1 | ����NaOH��Һ�����/mL |
1 | 20.00 | 0.1000 | 25.18 |
2 | 20.00 | 0.1000 | 23.06 |
3 | 20.00 | 0.1000 | 22.98 |
��1����ʵ����ָʾ�����ѡ��___________���ζ��ﵽ�յ�ı�־��_____________________��
��2���ų���ʽ�ζ��ܼ��������ݵķ���Ӧ��������_________���������/��/������Ȼ�����ἷѹ������ʹ���첿�ֳ�����Һ��

��3�������������ݣ��ɼ�����ô����Ũ��Ϊ_________mol��L-1������С�����4λ����
��4��������ʵ���У����в���������������ȷ������ɲⶨ���ƫ�ߵ���________��
A���õζ���ȡ20.00mL������ᣬʹ��ǰ��ˮϴ��δ�ô��������ϴ
B����ƿˮϴ��δ����
C������NaOH����ʱ����С����NaOH����
D���ζ��յ����ʱ����
E����ʽ�ζ��ܼ��첿�������ݣ��ζ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ�ҷ�����ˮ��Һ﮵��Ϊ�綯������չɨ�����ϰ���װ��ԭ������ͼ��ʾ�����й��屡Ĥֻ����Li+ͨ��������ӵ�ص��ܷ�ӦΪxLi +Li1-xMn2O4![]() LiMn2O4�������й�˵���������
LiMn2O4�������й�˵���������

A. �ŵ�ʱ��Li+�������屡Ĥ���뵽ˮ��Һ�������
B. �ŵ�ʱ��������ӦΪLi1-xMn2O4+xLi++xe-![]() LiMn2O4
LiMn2O4
C. �õ�ص�ȱ���Ǵ��ڸ���Ӧ:2Li +2H2O![]() 2LiOH+H2��
2LiOH+H2��
D. ���ʱ���缫bΪ����������������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȼ�ϵ��Ϊ��Դ���е���ʵ��װ��ʾ��ͼ����ͼ��ʾ������˵���У���ȷ����
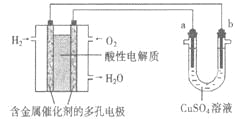
A.��a����ͭ��b��Ϊ��ʱ�����������1.6gO2��b��������6.4gͭ
B.ȼ�ϵ�ع���ʱ��������ӦΪ��O2 + 2H2O + 4e-�� 4OH-
C.��a���Ǵ�ͭ��b���Ǵ�ͭʱ��a�����ٵ���������b��������ͭ��������
D.��a��b��������ʯīʱ��b����ӦΪ4OH-- 4e-��O2��+ 2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
��![]() ��
��![]() ��
��![]() ���ڼ��������
���ڼ��������![]() ��
��![]() ��
��![]() ���ܺͼ���Һ������Ӧ��������������
���ܺͼ���Һ������Ӧ��������������
��̼���ơ������������Ȼ�李��������ƶ��������ӻ�����
�ۻ���Ư�ۡ�ˮ������![]() ���塢��ˮ�����
���塢��ˮ�����
�ܴ��ᡢ�ռ�������ʯ�ҷֱ������ᡢ��κ�������
�ݹ赼�磬����Ũ�����жۻ������������仯
���������ڻ�����Һ�ȡ�����������ڴ�����
A.�٢ۢ�B.�ܢݢ�C.�ڢܢ�D.�ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20ml0.1mol/L��ˮ��Һ�еμ����ᣬ��Һ��ˮ�����������Ũ���������������仯��ͼ��ʾ��������˵����ȷ���ǣ� ��

A.b��d����Ϊǡ����ȫ��Ӧ��
B.c����Һ��c(NH4+)=c(Cl-)
C.a��b֮�������һ�㣺c(Cl-)>c(NH4+)��c(H+)>c(OH-)
D.�����£�0.1mol/L��ˮ�ĵ��볣��KԼΪ1��10-5mol/L
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com