
| 分子 | 空间构型 | 分子有无极性 | 分子 | 空间构型 | 分子有无极性 |
| O2 | CS2 | ||||
| CO2 | H2O | ||||
| BF3 | NH3 | ||||
| CCl4 | 苯 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 分子 | 空间构型 | 分子有无极性 | 分子 | 空间构型 | 分子有无极性 |
| O2 | 直线形 | 无 | CS2 | 直线形 | 无 |
| CO2 | 直线形 | 无 | H2O | V形 | 有 |
| BF3 | 平面三角形 | 无 | NH3 | 三角锥形 | 有 |
| CCI4 | 正四面体形 | 无 | 苯 | 平面正六边形 | 无 |


科目:高中化学 来源: 题型:
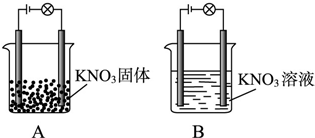 某一化学兴趣小组的同学在家中进行实验,按照图A连接好线路,发现灯泡不亮;按照图B连接好线路,发现灯泡亮了.以下结论中正确的是
某一化学兴趣小组的同学在家中进行实验,按照图A连接好线路,发现灯泡不亮;按照图B连接好线路,发现灯泡亮了.以下结论中正确的是| A、KNO3不是电解质 |
| B、KNO3溶液是电解质 |
| C、在KNO3溶液中,水电离出了大量的离子 |
| D、在水溶液中KNO3电离出了可以自由移动的离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
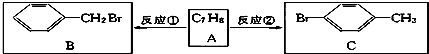
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
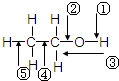 乙醇分子中各化学键如图所示,对乙醇在各种反应中断裂的键说明正确的是
乙醇分子中各化学键如图所示,对乙醇在各种反应中断裂的键说明正确的是| A、和金属钠作用时,键②断裂 |
| B、和浓硫酸共热至170℃时,键①和⑤断裂 |
| C、和乙酸、浓硫酸共热时,键①断裂 |
| D、在铜催化下和氧气反应时,键①和②断裂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com