
【题目】有机化合物甲和G都在生活中有很多用途,其合成路线如下:
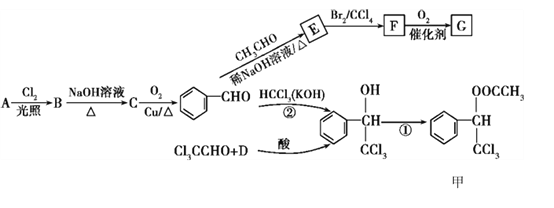
已知:①R1—CHO+R2—CH2—CHO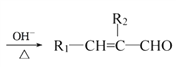 (R1、R2代表烃基或氢原子)
(R1、R2代表烃基或氢原子)
②D与A互为同系物;在相同条件下,D蒸气相对于氢气的密度为39。
(1)A的分子式是____,G中含氧官能团的名称是____。
(2)②的反应类型是____, F的结构简式为______。
(3)B的核磁共振氢谱有____组峰,峰面积之比为_____________。
(4)C有多种同分异构体,其中属于芳香族化合物的有____种。
(5)写出反应①的化学方程式:_____________。
(6)设计实验检验E中的官能团(说明实验操作步骤、现象及结论)____________
(7)G的同分异构体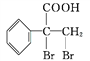 是一种重要的药物中间体,其合成路线与G相似,请以
是一种重要的药物中间体,其合成路线与G相似,请以![]() 为原料设计它的合成路线(其他所需原料自选,注明反应条件)________。
为原料设计它的合成路线(其他所需原料自选,注明反应条件)________。
【答案】 C7H8 羧基 加成反应 ![]() 4组峰 2:2:2:1 4
4组峰 2:2:2:1 4 ![]() +CH3COOH
+CH3COOH![]()
![]() +H2O 取适量E溶液于试管中,先加入过量的新制的氢氧化铜悬浊液,加热煮沸,出现砖红色的沉淀,证明含醛基;酸化后,再加溴水或酸性高锰酸钾溶液,溶液褪色,则证明含碳碳双键
+H2O 取适量E溶液于试管中,先加入过量的新制的氢氧化铜悬浊液,加热煮沸,出现砖红色的沉淀,证明含醛基;酸化后,再加溴水或酸性高锰酸钾溶液,溶液褪色,则证明含碳碳双键 
![]()
![]()
![]()
![]()
【解析】D与A互为同系物;在相同条件下,D蒸气相对于氢气的密度为39,则相对分子质量为78,结合Cl3CCHO与D反应生成 可推出D为苯,A为苯的同系物,且经过多步反应生成苯甲醛,故A为甲苯,甲苯在光照条件下与氯气发生取代反应生成B为
可推出D为苯,A为苯的同系物,且经过多步反应生成苯甲醛,故A为甲苯,甲苯在光照条件下与氯气发生取代反应生成B为![]() ,
,![]() 在氢氧化钠的水溶液中加热发生取代反应生成C为
在氢氧化钠的水溶液中加热发生取代反应生成C为![]() ,
,![]() 在铜的催化下发生氧化反应生成
在铜的催化下发生氧化反应生成![]() ,
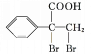
,![]() 与乙醛在稀氢氧化钠溶液中加热发生加成反应得到E为
与乙醛在稀氢氧化钠溶液中加热发生加成反应得到E为![]() ,
,![]() 与溴的四氯化碳溶液发生加成反应生成F为
与溴的四氯化碳溶液发生加成反应生成F为![]() ,
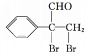
,![]() 在催化剂作用下与氧气发生氧化反应生成G为
在催化剂作用下与氧气发生氧化反应生成G为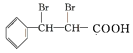 。(1)A为甲苯,分子式是C7H8,G为
。(1)A为甲苯,分子式是C7H8,G为 ,含氧官能团的名称是羧基;(2)②是
,含氧官能团的名称是羧基;(2)②是![]() 与三氯甲烷在碱溶液中发生加成反应生成
与三氯甲烷在碱溶液中发生加成反应生成 ,反应类型是加成反应, F的结构简式为
,反应类型是加成反应, F的结构简式为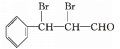 ;(3)B为
;(3)B为![]() ,的核磁共振氢谱有4组峰,峰面积之比为2:2:2:1;(4)C为
,的核磁共振氢谱有4组峰,峰面积之比为2:2:2:1;(4)C为![]() ,有多种同分异构体,其中属于芳香族化合物的有甲苯醚、对甲基苯酚、间甲基苯酚、邻甲基苯酚共4种;(5)反应①是
,有多种同分异构体,其中属于芳香族化合物的有甲苯醚、对甲基苯酚、间甲基苯酚、邻甲基苯酚共4种;(5)反应①是 与乙酸发生酯化反应生成
与乙酸发生酯化反应生成![]() ,反应的化学方程式为:
,反应的化学方程式为: ![]() +CH3COOH
+CH3COOH![]()
![]() +H2O;(6)E为
+H2O;(6)E为![]() ,所含官能团为碳碳双键和醛基,必须先检验醛基再检验碳碳双键,故检验方法为:取适量E溶液于试管中,先加入过量的新制的氢氧化铜悬浊液,加热煮沸,出现砖红色的沉淀,证明含醛基;酸化后,再加溴水或酸性高锰酸钾溶液,溶液褪色,则证明含碳碳双键;(7)G的同分异构体
,所含官能团为碳碳双键和醛基,必须先检验醛基再检验碳碳双键,故检验方法为:取适量E溶液于试管中,先加入过量的新制的氢氧化铜悬浊液,加热煮沸,出现砖红色的沉淀,证明含醛基;酸化后,再加溴水或酸性高锰酸钾溶液,溶液褪色,则证明含碳碳双键;(7)G的同分异构体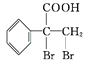 是一种重要的药物中间体,其合成路线与G相似,
是一种重要的药物中间体,其合成路线与G相似, ![]() 与甲醛在稀氢氧化钠溶液中加热反应生成
与甲醛在稀氢氧化钠溶液中加热反应生成![]() ,
,![]() 与溴的四氯化碳溶液反应生成
与溴的四氯化碳溶液反应生成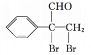 ,
, 催化氧化得到
催化氧化得到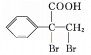 ,合成路线如下:
,合成路线如下: 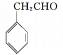
![]()
![]()
![]()

![]()

。


科目:高中化学 来源: 题型:
【题目】下列化学过程对应的方程式表示正确的是 ( )
A. 碳酸氢钠溶液的水解:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. 醋酸的电离:CH3COOH=CH3COO-+H+
C. 碳酸钙的溶解平衡CaCO3(s) ![]() Ca2+(aq)+CO32-(aq)
Ca2+(aq)+CO32-(aq)
D. 硫化钠溶液呈碱性的原因:S2-+H2O![]() H2S+2OH-
H2S+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年我国通过蛟龙一号在东海试采可燃冰成功,可燃冰的主要成分是甲烷。下列说法不正确的是( )
A.甲烷属于烃类B.甲烷是天然气的主要成分
C.甲烷能发生取代反应D.甲烷能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以酸性氢氧燃料电池为电源进行电解的实验装置如图所示。下列说法正确的是( )
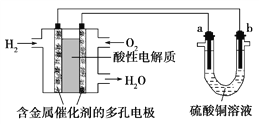
A. 燃料电池工作时,正极反应为O2+2H2O+4e-===4OH-
B. a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
C. 电解过程中SO42— 移向b极
D. a、b两极若是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.催化剂可以改变化学反应速率
B.2 mol SO2与l mol O2混合一定能生成2 mol SO3
C.食物放在冰箱中会减慢食物变质的速率
D.化学反应达到反应限度时,正反应的速率与逆反应的速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按图装置进行实验,下列现象能推断出结论的是( )
选项 | 试剂X | Y中试剂及现象 | 结论 | 装置 |
A | 一种盐 | 酚酞溶液未变红 | 该盐不可能是铵盐 |
|
B | 小苏打和纯碱 | 石灰水变浑浊 | 纯碱比小苏打稳定 | |
C | 氢氧化钙与氯化铵 | 硝酸银溶液中先产生沉淀后溶解 | Ag2O能溶于氨水 | |
D | 氯酸钾与二氧化锰 | 淀粉、碘化钾和和硫酸的混合溶液变蓝 | 反应产生了Cl2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下,用一定量的水吸收氨气后制得浓度为12.0mol·L-1、密度为0.915g·cm-3的氨水。试计算1体积水吸收____________体积的氨气可制得上述氨水。(水的密度以1.00g·cm-3计)
(2) 硫铁矿高温下空气氧化产生二氧化硫:4FeS2+11O2 = 8SO2+2Fe2O3设空气中N2、O2的含量分别为0.800和0.200(体积分数),试完成下列各题:
①1.00mol FeS2完全氧化,需要空气的体积(标准状况)为________L
②55L空气和足量FeS2完全反应后,气体体积(同温同压)变为________L
③设FeS2氧化产生的气体混合物为100L,其中O2为aL,SO2为bL。写出a和b的关系式:________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中的一些问题常涉及化学知识,下列叙述正确的是
A.棉花的主要成分是纤维素
B.过多食用糖类物质如淀粉等不会致人发胖
C.淀粉在人体内直接水解生成氨基酸,供人体组织的营养需要
D.纤维素在人体消化过程中起重要作用,纤维素可以作为人类的营养物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四支试管中分别加入足量锌粒,在不同条件下发生反应:Zn+2H+=Zn2++H2↑。已知其他条件一定时,化学反应速率与物质的量浓度有关,请判断产生H2的反应速率最快的是 ( )
试管 | 温度 | 酸 | 水 |
① | 20℃ | 2mL 3mol·L-1H2SO4 | 8mL |
② | 20℃ | 8mL 4mol·L-1HCl | 2mL |
③ | 20℃ | 4mL 8mol·L-1CH3COOH | 6mL |
④ | 20℃ | 10mL 4mol·L-1NaHSO4 | 0 |
A. ① B. ② C. ③ D. ④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com