
【题目】高铁酸盐在能源、环保等方面有着广泛用途。
(1)化学氧化法生产高铁酸钾(K2FeO4)是用固体Fe2O3、KNO3、KOH混合加热生成紫红色高铁酸钾和KNO2等产物。此反应中氧化剂与还原剂的物质的量之比为_____________。
(2)工业上湿法制备高铁酸钾(K2FeO4)的工艺如图所示:
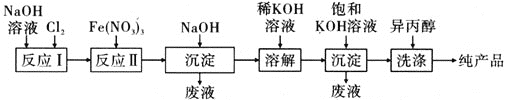
①反应Ⅰ的化学方程式为_________________________________________________。
②反应Ⅱ的离子方程式为_________________________________________________。
③加入饱和KOH溶液的目的是_________________________________________________。
④高铁酸钾是一种理想的水处理剂,其处理水的原理为____________________________。
⑤实验室配制Fe(NO3)3溶液,为防止出现浑浊,一般是将Fe(NO3)3固体溶于稀HNO3后再加水稀释。已知25 ℃时,Ksp[Fe(OH)3]=4×10-38,此温度下在实验室中配制100 mL 5 mol·L-1 Fe(NO3)3溶液,则至少需要________mL、4 mol·L-1 HNO3。

(3)高铁酸钠(Na2FeO4)制备可采用三室膜电解技术,装置如图所示,阳极的电极反应式为________。电解后,阴极室得到的A溶液中溶质的主要成分为________(填化学式)。
【答案】3∶1 2NaOH +Cl2=NaCl+NaClO+H2O 3ClO+10OH+2Fe3+=2FeO42-+3Cl+5H2O 增大K+浓度,促进K2FeO4晶体析出 K2FeO4具有强氧化性,能杀菌消毒,产生的Fe3+水解生成Fe(OH)3胶体具有吸附性 1.25 Fe6e+8OH=FeO42-+4H2O NaOH
【解析】
(1)由条件可知发生反应:![]() ,以此分析;
,以此分析;
(2)①反应Ⅰ:![]() ;②反应Ⅱ:
;②反应Ⅱ:![]() ;③加入饱和KOH溶液利用平衡
;③加入饱和KOH溶液利用平衡![]() 回答;④K2FeO4具有强氧化性,能杀菌消毒,产生的Fe3+水解生成Fe(OH)3胶体具有吸附性;⑤利用溶度积计算;
回答;④K2FeO4具有强氧化性,能杀菌消毒,产生的Fe3+水解生成Fe(OH)3胶体具有吸附性;⑤利用溶度积计算;
(3)阳极与电源正极相连为Fe极发生氧化反应:![]() ;阴极发生还原反应:
;阴极发生还原反应:![]() ,A溶液为NaOH。
,A溶液为NaOH。
(1)Fe元素化合价升高,化合价由+3价升高到+6价,被氧化,N元素化合价由+5价降低+3价,![]() ,所以氧化剂与还原剂的物质的量之比为3:1,故答案为:3:1;
,所以氧化剂与还原剂的物质的量之比为3:1,故答案为:3:1;
(2)①反应Ⅰ为氧化还原反应,方程式为:![]() ;
;
②反应Ⅱ为氧化还原反应,+3价铁被氧化成+6价铁,+1价的氯被还原为-1价,
反应的离子方程式为![]() ,
,
③![]() ,加入饱和KOH溶液可以增大K+的浓度,使平衡向右移动,析出晶体,
,加入饱和KOH溶液可以增大K+的浓度,使平衡向右移动,析出晶体,
故答案为:增大K+的浓度,促进K2FeO4晶体析出;
④K2FeO4具有强氧化性,可用于杀菌消毒,可生成Fe(OH)3,具有吸附性,可除去水的悬浮性杂质,
故答案为:K2FeO4具有强氧化性,能杀菌消毒,产生的Fe3+水解生成Fe(OH)3胶体具有吸附性,
⑤根据溶度积公式![]() 可计算
可计算![]() ,由水的离子积可知
,由水的离子积可知![]() 。设需要xmL、4 mol·L-1HNO3,则xmL×4mol·L-1=0.05mol·L-1×100mL,解得x=1.25
。设需要xmL、4 mol·L-1HNO3,则xmL×4mol·L-1=0.05mol·L-1×100mL,解得x=1.25
故答案为:1.25。
(3)阳极是失去电子发生氧化反应,金属铁有还原性故阳极的电极反应为:![]() ;阴极氢离子得电子生成氢气,所以溶液中的溶质为NaOH;故答案为:
;阴极氢离子得电子生成氢气,所以溶液中的溶质为NaOH;故答案为:![]() ; NaOH。
; NaOH。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是( )
A.与NaOH反应的氯气为0.25 mol
B.n(Na+):n(Cl-) 可能为7:3
C.若反应中转移的电子为n mol,则0.15n0.25
D.n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2 mol X和2 mol Y充入2 L密闭容器中发生如下反应:X(g)+3Y(g) ![]() 2Z(g)+a Q(g)
2Z(g)+a Q(g)
达到平衡时生成0.8 mol Z,测得Q的浓度为0.4 mol/L,下列叙述错误的是
A.a的值为2 B.平衡时X的浓度为0.2 mol/L
C.平衡时Y的转化率为60% D.平衡时Z的体积百分含量为20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散。下列判断正确的是( )
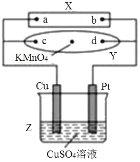
A.滤纸上c点附近会变红色
B.Cu电极质量减小,Pt电极质量增大
C.Z中溶液的pH先减小,后增大
D.溶液中的SO42-向Cu电极定向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白桦脂酸对白血病等恶性肿瘤细胞有抑制作用,其结构简式如图所示,在白桦脂酸中加入合适的试剂检验其官能团(必要时可加热),下列试剂、现象、结论都正确的一项是

选项 | 试剂 | 现象 | 结论 |
A | 氯化铁溶液 | 溶液变色 | 含有羟基 |
B | 银氨溶液 | 有银镜产生 | 含有醛基 |
C | 碳酸氢钠溶液 | 有气泡产生 | 含有羧基 |
D | 酸性KMnO4溶液 | 溶液褪色 | 含有碳碳双键 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO可用于合成甲醇,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
(1)如图是反应CO(g)+2H2(g)![]() CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
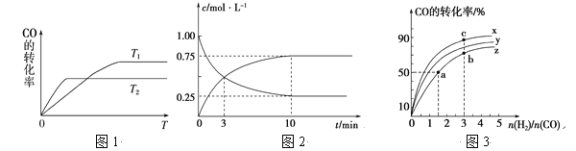
①该反应的焓变ΔH________0 (填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______ K2 (填“>”、“<”或“=”)。在T1温度下,往体积为1 L的密闭容器中,充入1 mol CO和2 mol H2,经测得CO和CH3OH(g)的浓度随时间变化如图所示。则该反应的平衡常数为______________。
③若容器容积不变,下列措施可增加CO转化率的是________(填字母)。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
(2)在容积为1 L的恒容容器中,分别研究在230 ℃、250 ℃和270 ℃三种温度下合成甲醇的规律。如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线z对应的温度是________℃;曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A(C11H8O4)在氢氧化钠溶液中加热反应后再酸化可得到化合物B和C.回答下列问题:
(1)B的分子式为C2H4O2,分子中只有一个官能团.则B的结构简式是 ,B与乙醇在浓硫酸催化下加热反应生成D,该反应的化学方程式是 ,该反应的类型是 ;写出两种能发生银镜反应的B的同分异构体的结构简式 .
(2)C是芳香化合物,相对分子质量为180,其碳的质量分数为60.0%,氢的质量分数为4.4%,其余为氧,则C的分子式是 .
(3)已知C的芳环上有三个取代基,其中一个取代基无支链,且还有能使溴的四氯化碳溶液褪色的官能团及能与碳酸氢钠溶液反应放出气体的官能团,则该取代基上的官能团名称是 .另外两个取代基相同,分别位于该取代基的邻位和对位,则C的结构简式是 .
(4)A的结构简式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机合成工厂以植物秸秆或木材为初始原料经过生物发酵,制备聚酯纤维H和医药中间体E,其合成路线如下图所示:
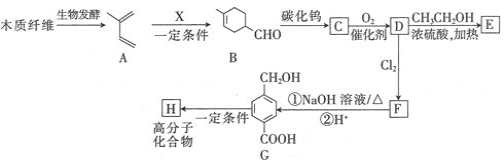
已知:①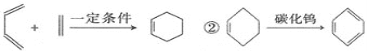
回答下列问题:
(1)A的化学名称是________;B所含官能团的名称是________。
(2)X的结构简式________;G→H的反应类型是________。
(3)D→E的化学方程式________。
(4)符合下列条件的G同分异构体共有________种;其中核磁共振氢谱有五组峰的结构简式________。
①能发生银镜反应;②能与FeCl3溶液发生显色反应;③能发生水解反应。
(5)参照上述合成路线,利用CH2=CH-CH=CH2为初始原料设计合成![]() 的路线_______________。
的路线_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com