
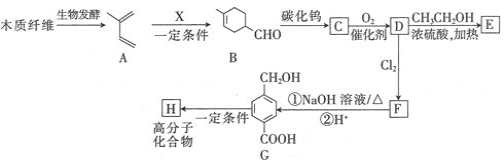
����Ŀ��ij�л��ϳɹ�����ֲ��ոѻ�ľ��Ϊ��ʼԭ�Ͼ�������ͣ��Ʊ�������άH��ҽҩ�м���E����ϳ�·������ͼ��ʾ��
��֪����
�ش��������⣺
(1)A�Ļ�ѧ������________��B���������ŵ�������________��
(2)X�Ľṹ��ʽ________��G��H�ķ�Ӧ������________��
(3)D��E�Ļ�ѧ����ʽ________��
(4)��������������Gͬ���칹�干��________�֣����к˴Ź��������������Ľṹ��ʽ________��
���ܷ���������Ӧ��������FeCl3��Һ������ɫ��Ӧ�����ܷ���ˮ�ⷴӦ��
(5)���������ϳ�·�ߣ�����CH2=CH-CH=CH2Ϊ��ʼԭ����ƺϳ�![]() ��·��_______________��
��·��_______________��
���𰸡�2-��-1,3-����ϩ�������ϩ�� ̼̼˫����ȩ�� CH2��CHCHO ���۷�Ӧ  +CH3CH2OH
+CH3CH2OH![]()
 +H2O 13
+H2O 13 ![]()
��������
����֪��������B�Ľṹ��ʽ��֪X�к���̼̼˫��������һ��ȩ������XΪCH2��CHCHO��������֪�����ڿ�֪CΪ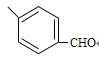 ,C�е�ȩ����������ת��Ϊ�Ȼ���DΪ
,C�е�ȩ����������ת��Ϊ�Ȼ���DΪ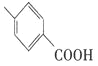 �� D���Ҵ���Ũ���������£�����������Ӧ��EΪ
�� D���Ҵ���Ũ���������£�����������Ӧ��EΪ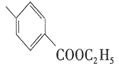 ������G�Ľṹ��ʽ����֪G�е��ǻ�����±��ԭ��ˮ��õ���FΪ
������G�Ľṹ��ʽ����֪G�е��ǻ�����±��ԭ��ˮ��õ���FΪ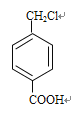 ��G�к��С�OH����COOH�����Է������۷�Ӧ���Դ˻ش�
��G�к��С�OH����COOH�����Է������۷�Ӧ���Դ˻ش�
(1)������Ž�����֧���߿�ʼ��ţ�2��̼���м�����A�Ļ�ѧ�����ǣ�2-��-1,3-����ϩ��B������������̼̼˫����ȩ�����ʴ�Ϊ��2-��-1,3-����ϩ�������ϩ����̼̼˫����ȩ����
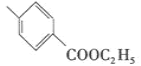
(2)����֪�����ٺ�B�Ľṹ��ʽ��֪X�к���̼̼˫��������һ��ȩ������XΪCH2��CHCHO��G�к��С�OH����COOH���ҿ��Է�����Ӧ����G���Է������۷�Ӧ��G��H�ķ�Ӧ���������۷�Ӧ���ʴ�Ϊ��CH2��CHCHO�����۷�Ӧ��
(3) D���Ҵ���Ũ���������£�����������Ӧ��D���Ȼ��ѵ��ǻ���E�еĴ����ǻ��е�H����D��E�Ļ�ѧ����ʽ +CH3CH2OH
+CH3CH2OH![]()
 +H2O���ʴ�Ϊ��
+H2O���ʴ�Ϊ�� +CH3CH2OH
+CH3CH2OH![]()
 +H2O��
+H2O��
(4)Ҫ����������Ӧ���������ȩ����FeCl3�ܺͱ��ӷ�����ɫ���������ʿ��Է���ˮ�⣬����G�ķ�����ֻ��3��Oԭ�ӣ���FeCl3������ɫ��Ӧ��˵����-OH,����Ҫͬʱ�����ܷ���������Ӧ��ˮ�ⷴӦ����ֻ��Ϊ�����γɵ���������ԭ����HCOO-����ȥ������HCOO-�������л���1��Cԭ�ӣ����������У�Ҳ�����ǵ����ļ������Ϊ�����������������2��ȡ�����ֱ�Ϊ��OH��HCOOCH2������3�֣��ڡ��䡢�ԣ�����������3��ȡ�������ֱ�Ϊ��OH��HCOO����CH3������10�֣���һ��Ϊ13�֣����к˴Ź��������������Ľṹ˵����ͬ���������֣��ǻ��ϵ�H����HCOO����H�ֱ�ռ��1��壬��һ��C�ϵ�Hռ��1��壬���ϵ�Hռ��2��壬������ȡ�������ڶ��飬����������ֻ��![]() ���ʴ�Ϊ��13
���ʴ�Ϊ��13![]() ��
��
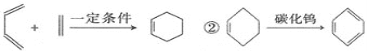
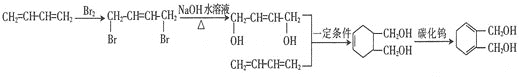
(5)Ŀ������к���һ������������ԭ��Ϊ1,3-����ϩ��������A������ģ��A��C�IJ��裬������Ҫ�õ�ֻ����һ��̼̼˫�������ʡ�Ŀ������е�2����OH������ͨ��±��ԭ��ˮ��õ���2����OH֮�����4��Cԭ�ӣ���ϵ��˫ϩ����1,4-�ӳɣ��ȿ�������±��ԭ�ӣ��ֿ��Եõ�����һ��̼̼˫�������ʡ���
����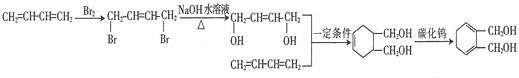 ��
��


 ������ҵ��ͬ����ϰ��ϵ�д�
������ҵ��ͬ����ϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Դ�������ȷ������Ź㷺��;��
(1)��ѧ����������������أ�K2FeO4�����ù���Fe2O3��KNO3��KOH��ϼ��������Ϻ�ɫ������غ�KNO2�Ȳ���˷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ_____________��
(2)��ҵ��ʪ���Ʊ�������أ�K2FeO4���Ĺ�����ͼ��ʾ��
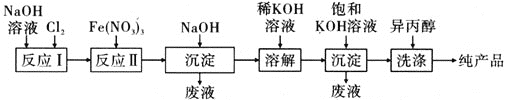
����Ӧ���Ļ�ѧ����ʽΪ_________________________________________________��
����Ӧ�������ӷ���ʽΪ_________________________________________________��
�����뱥��KOH��Һ��Ŀ����_________________________________________________��
�����������һ�������ˮ���������䴦��ˮ��ԭ��Ϊ____________________________��
��ʵ��������Fe��NO3��3��Һ��Ϊ��ֹ���ֻ��ǣ�һ���ǽ�Fe��NO3��3��������ϡHNO3���ټ�ˮϡ�͡���֪25 ��ʱ��Ksp[Fe��OH��3]��4��10-38�����¶�����ʵ����������100 mL 5 mol��L-1 Fe��NO3��3��Һ����������Ҫ________mL��4 mol��L-1 HNO3��

(3)�������ƣ�Na2FeO4���Ʊ��ɲ�������Ĥ��⼼����װ����ͼ��ʾ�������ĵ缫��ӦʽΪ________�����������ҵõ���A��Һ�����ʵ���Ҫ�ɷ�Ϊ________���ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж��ֻ��ϼۣ����γɶ��ֻ������ҵ���û���̿��ԭ������NO���йط�ӦΪ��C(s) + 2NO(g)![]() N2(g) + CO2(g)�����ܱյ�2L�����У�����NO�������Ļ���̿�����������·�Ӧ��
N2(g) + CO2(g)�����ܱյ�2L�����У�����NO�������Ļ���̿�����������·�Ӧ��
��1����2min�������ܶ�������1.2 g/L��������ƽ����Ӧ����Ϊ___________mol/(L�� min)��
��2���û�ѧƽ�ⳣ������ʽK =__________________����֪�����¶�ʱ��K����������ӦΪ______��������������������������Ӧ��
��3�����¶Ȳ���������£�Ҫ���NO��ƽ��ת���ʣ����Բ�ȡ�Ĵ�ʩ��____________��
��4�����и������жϸ÷�Ӧ�ﵽƽ�����____________________���������ĸ����
a��������ѹǿ���ֲ��䡡�� b��2v��(NO)��v��(N2)
c����������ƽ�������������� d�����������ܶȱ��ֲ���
��5����֪NaNO2��Һ�ʼ��ԣ���NaNO2��Һ������Ũ���ɴ�С��˳����_______________��
��6���ڴ��������£�NH3����������NO����Ⱦ���������ֶԻ����������ʡ�д����Ӧ�Ļ�ѧ����ʽ��____________�����б�������Ԫ��____ ���÷�Ӧ�����������뻹ԭ��������ʵ���֮����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��0.005molL��1Ba(
OH)
2��Һ��pHֵΪ��������
A.10B.11C.12D.13
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ҫ�Ļ���ԭ�ϡ�
(1)���鰱����������ˮ�ļ����ǣ��ռ�һ�Թܰ�����______________��
(2)������ʳ��ˮ������ͨ��������NH3��������CO2�����ɳ����Ļ�ѧʽΪ_________�����˺�ʹ��Һ�����������϶�NH4Cl����ķ����ǣ���ͨ��������NH3����ȴ������________����˵����������Ϊʲô���������϶�NH4Cl��ԭ��_________________��ijNaHCO3�����к���NaCl���ʣ�ijͬѧ�ڲⶨ����NaHCO3�ĺ���ʱ����ȡ5.000g���������ݳ�100mL��Һ���ñ�������Һ�ζ�(�ü�����ָʾ��)���ⶨ���ݼ�¼���£�
�ζ����� | ����Һ(mL) | 0.5000mol/L������Һ�����(mL) | |
������ | �ն��� | ||
��һ�� | 20.00 | 1.00 | 21.00 |
�ڶ��� | 20.00 | ��ͼ�� | ��ͼ�� |
(3)���ݹ�������Ҫ�õ����������ձ�����������___________��____________��
(4)���ζ���__________________________����Ϊ�ζ��յ㣻�ڶ��εζ�����ͼIͼII��ʾ���ĵ�������Һ���Ϊ_________mL��
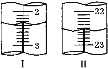
(5)��ʵ��ⶨ��Ʒ��NaHCO3����������Ϊ__________(����2λС��)��
(6)����ͬѧ�ⶨ���ƫ����д��һ����ɸ�����ԭ��_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѡ����ȷ����![]()
A.ʹPH��ֽ��ɺ�ɫ����Һ�����ܴ��ڴ����ģ�![]() ��
��![]() ��
��![]() ��
��![]()
B.![]() ��Һ�У����ܴ��ڴ����ģ�
��Һ�У����ܴ��ڴ����ģ�![]() ��
��![]() ��
��![]() ��
��![]()
C.�����ữ�ĵ���KI��Һ�ڿ����б����ɫ��![]()
D.![]() ��Һ�еμ���������ʯ��ˮ��
��Һ�еμ���������ʯ��ˮ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ϡ������ͭ��Ӧ�Ʊ�NO���壬�������ͼ��װ��(��ƿ�ڼ���ϡ�����ͭƬ����Ҫʱ�ɼ���)��ʵ��Ч������ʮ�����룬��Ϊ�۲쵽������������֤����Ӧ������NO�����������ͼ��װ��(��Ƥ���¶�����ͭ˿Ȧ)����������ʵ����Դﵽ�����Ч����
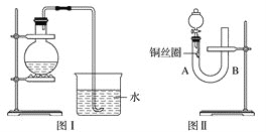
(1)��ͼ��װ����ʵ��ʱ������ˮ���ռ������������ɫΪ_____ɫ��ʵ�����������______�����۲쵽____________���ɣ��Ӷ���������֤����Ӧ������NO��
(2)��ͼ��װ����ʵ��ʱ�����йز���������ȫ��
�ٽ���Һ©���Ļ�������U�ιܵ�B��ܿ�ע��ϡ���ᣬһֱע��____________Ϊֹ��
�ڹرջ������þƾ�����U�ιܵ�A����ȣ���______ʱ��������ȥ�ƾ��ơ�
(3)����ͼ��װ�õ�ʵ������������⣺
�ٷ�Ӧ��ʲô����¿����Զ�ֹͣ��________________________��
���ںδ��۲쵽��ɫ��NO���壿____________________________________________��
���������Һ©���Ļ����������������۲쵽��Щ��������_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ����
A. ϡ������ϡ����������Һ�����кͷ�Ӧ���Ȼ�ѧ����ʽΪCH3COOH (aq) + NaOH (aq) = CH3COONa(aq) + H2O(l) ��H=![]() 57.3kJ/mol
57.3kJ/mol
B. ��101kPaʱ1mol����ȼ��ʱ�ķ�Ӧ�Ƚ��������ʵ�ȼ����
C. δ��������Ϊ����Դ������һ���ŵ��dz��ȼ�յIJ��ﲻ��Ⱦ����
D. �����¶Ȼ������������Ըı仯ѧ��Ӧ�ķ�Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ǵ�ͳ�в�ҩ���˵���Ч�ɷ�֮һ��������ϸ����ɱ���ж������á������йغ������ص�������ȷ����( )
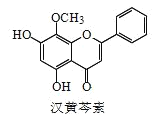
A.�������صķ���ʽΪ C16H13O5
B.������ H2�����ӳɷ�Ӧ�÷����й����ŵ�������� 1 ��
C.1 mol ����������ˮ��Ӧ��������� 1mol Br2
D.�������� FeCl3 ��Һ��ɫ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com