
【题目】某化学研究性学习小组用CO还原Fe2O3,并在实验结束后用磁铁吸出生成的黑色粉末X进行探究。
[探究目的] 分析黑色粉末X的组成,并进行相关实验。
[查阅资料]
①CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引。
②Fe3O4+8H+=2Fe3++Fe2++4H2O
③Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
④3Fe3O4+28HNO3(稀)=9Fe(NO3)3+NO↑+14H2O
[实验探究]
I.定性检验
编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管1中,注入浓盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有气泡产生 |
② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液出现血红色 |
③ | 另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 | 有极少量红色物质析出,仍有较多黑色固体未溶解 |
(1)实验③发生的反应的离子方程式为_____________________________。
(2)上述实验说明黑色粉末X中含有_______________________________。
II.定量测定
根据下图所示的实验方案进行实验并记录数据:
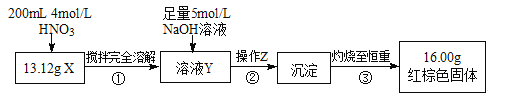
(1)操作Z的名称是_________。
(2)通过以上数据,得出13.12g黑色粉末X中各成分的物质的量为_________。
(3)若溶液Y的体积仍为200mL,则溶液Y中c(Fe3+)=________mol/L。
【答案】Fe+Cu2+=Fe2++Cu Fe和Fe3O4 过滤 Fe :0.11mol Fe3O4:0.03mol 1
【解析】
I.(1)极少量红色物质为铜,该反应为铁粉和硫酸铜反应生成铜和硫酸亚铁,发生了金属的置换反应,离子方程式为Fe+Cu2+=Fe2++Cu;(2)铁能和盐酸反应生成气体,且铁和铜离子发生置换反应生成红色的铜,据此现象判断存在铁;Fe3+能使KSCN溶液呈现血红色,这是Fe3+的特征反应,据此判断Fe3O4的存在.故黑色粉末X为Fe3O4和Fe的混合物;
Ⅱ.(1)通过加硝酸溶解和足量的氢氧化钠溶液,生成了氢氧化铁沉淀,因此操作Z为过滤;
(2)红棕色固体为氧化铁,16g氧化铁中含有铁原子的物质的量为16g÷160g/mol×2=0.2mol,设13.12g混合固体中铁的物质的量为xmol,Fe3O4的物质的量为ymol,则
①x+3y=0.2mol②56x+232y="13.12" 两式联立求得x=0.11mol,y=0.03mol,故答案为Fe:0.11mol、Fe3O4:0.03mol;(3)通过(2)中计算可知铁离子的物质的量为0.2mol,因此c(Fe3+)=0.2mol/0.2L=1mol/L。


科目:高中化学 来源: 题型:
【题目】对于反应aA(g)+bB(g)![]() cC(g)+dD(g) ΔH,反应特点与对应的图像的说法中不正确的是( )
cC(g)+dD(g) ΔH,反应特点与对应的图像的说法中不正确的是( )

A.图甲中,若p1>p2,则在较低温度下有利于该反应自发进行
B.图乙中,若T2>T1,则ΔH<0且a+b=c+d
C.图丙中,t1时刻改变的条件一定是使用了催化剂
D.图丁中,若ΔH<0,则纵坐标不可能表示的是反应物的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行了如图所示的实验,由实验现象得到的结论中正确的是
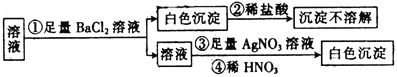
A.原溶液中一定只含有SO![]()
B.原溶液中一定含有SO![]() 和Cl-
和Cl-
C.原溶液中一定只含有Cl-
D.原溶液中可能含有SO![]() ,也可能含有Cl-
,也可能含有Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀。利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本。
(1)工业上处理100L Cr2O72-含量为108mgL-1的含铬废水,至少需要______L(标准状况) SO2。
(2)已知:Ksp[Cr(OH)3]=1×10-30,室温下,除去被SO2还原所得溶液中的Cr3+(使其浓度小于1×10-6molL-1),需调节溶液pH______。
(3)三价铬Cr(III)与双氧水反应可用于合成铬黄(PbCrO4),控制其他条件不变,调节反应温度,考察反应温度对Cr(III)转化率的影响(如图所示),温度超过70℃时,Cr(III)转化率下降的原因是______。
(4)光照下,草酸(H2C2O4)也能将Cr2O72-转化为Cr3+,化学式为Al2Fe(SO4)4的某发盐(毛发状,在空气中能被氧化)对该反应具有催化作用,为确定一瓶久置发盐的化学成分,学习小组进行如下实验:
取一定质量的发盐样品溶于足量的稀硫酸中,将溶液分为两等份,其中一份与酸性KMnO4溶液充分反应(反应后MnO4-被还原成Mn2+),消耗浓度为0.4000molL-1的KMnO4溶液20.00mL;往另一份溶液中加入足量稀氨水,在空气中微热并搅拌使之充分反应,待沉淀不再变化后过滤,将沉淀洗涤并充分灼烧后称量,得9.100g干燥固体粉末。通过计算与合理猜想,推测该久置发盐的可能化学组成(请给出计算过程与推测理由)。_________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行X2(g)+4Y2(g) ![]() 2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别为:0.1 mol/L、0.4 mol/L、0.2 mol/L、0.3 mol/L,达到平衡,各物质的浓度不可能为( )
2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别为:0.1 mol/L、0.4 mol/L、0.2 mol/L、0.3 mol/L,达到平衡,各物质的浓度不可能为( )
A.c(X2)=0.15 mol/LB.c(Y2)=0.9 mol/L
C.c(Z2)=0.3 mol/LD.c(Q2)=0.54 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定某溶液的离子组成,进行如下实验:①测定溶液的pH,溶液显强碱性。②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。③在上述②溶液中再滴加![]() 溶液,产生白色沉淀;④
溶液,产生白色沉淀;④![]() 取③中上层清液继续滴加
取③中上层清液继续滴加![]() 溶液至无沉淀时,再滴加
溶液至无沉淀时,再滴加![]() 溶液,产生白色沉淀。根据实验以下推测正确的是
溶液,产生白色沉淀。根据实验以下推测正确的是
A.一定有![]() 离子B.不一定有
离子B.不一定有![]() 离子
离子
C.不能确定![]() 离子是否存在D.不能确定
离子是否存在D.不能确定![]() 离子是否存在
离子是否存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HClO是比H2CO3还弱的酸,氯水中存在下列平衡:Cl2+H2O![]() HCl+HClO;HClO
HCl+HClO;HClO![]() H++ClO-,达到平衡后,要使HClO的浓度增大,可加入下列物质:
H++ClO-,达到平衡后,要使HClO的浓度增大,可加入下列物质:
A.SO2B.NaHCO3C.HClD.NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来食品安全问题成为社会各界日益关注的焦点话题.香港地区食环署食物安全中心曾对十五个桂花鱼样本进行化验,结果发现十一个样本中含有孔雀石绿。孔雀石绿是化工产品,具有较高毒性,高残留,且长期服用后,容易致癌、致畸,对人体有害。其结构简式如图所示。下列关于孔雀石绿的说法正确的是( )
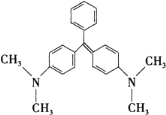
A.孔雀石绿的分子式为C23H25N2
B.1mol孔雀石绿在一定条件下最多可与6molH2发生加成反应
C.孔雀石绿属于芳香烃
D.孔雀石绿苯环上的一氯取代物有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:
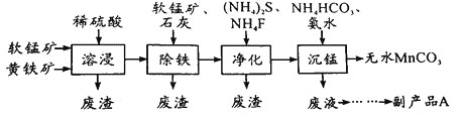
回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有__________________(写一条)。
(2)除铁工序中,在加入石灰调节溶液的pH前,加入适量的软锰矿,其作用是______________。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01 molL-1,滤液中残留的c(Ca2+)=________________〔已知:Ksp(CaF2)=1.46×10-10〕,
(4)沉锰工序中,298K、c(Mn2+)为1.05 molL-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图所示。根据图中信息得出的结论是______________。
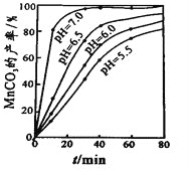
(5)沉锰工序中有CO2生成,则生成MnCO3的离子方程式是______________________。
(6)从沉锰工序中得到纯净MnCO3的操作方法是___________________。副产品A的化学式是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com