
| n |
| V |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、气态氢化物稳定性:W<T |
| B、离子半径:X<R |
| C、最高价氧化物对应水化物碱性:X>Y |
| D、Y单质能与冷水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
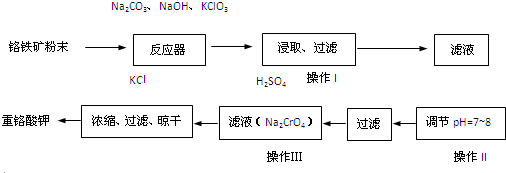
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Q1>Q2 |
| B、Q1=Q2 |
| C、Q1<Q2 |
| D、无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等量的硫蒸气和硫固体分别完全燃烧,前者放出热量多 |
| B、电解池是将化学能转化为电能的装置 |
| C、任何酸溶液与碱溶液发生中和反应生成1mol水时放出的热量一定是相等的 |
| D、需要加热才能发生的反应一定是吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com