
用饱和FeCl3溶液制取Fe(OH)3胶体,正确的操作是( )
A.将FeCl3溶液滴入蒸馏水中即可
B.将FeCl3溶液滴入热水中,生成棕黄色液体即可
C.将FeCl3溶液滴入沸水中,并继续煮沸至生成红褐色液体即可
D.将FeCl3溶液滴入沸水中,并继续煮沸至生成红褐色沉淀即可
科目:高中化学 来源: 题型:
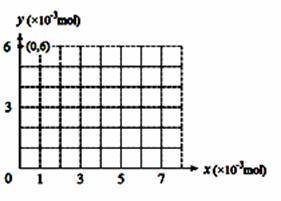
已知氧化性强弱顺序为BrO3->ClO3->Cl2>IO3->Br2>I2。某同学为验证其中某些离子的氧化性进行如下实验。向盛有30 mL 0.2 mol·L-1 KI溶液的锥形瓶中滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液至过量。
(1)开始滴加KBrO3溶液时的现象为 此时溶液中I-完全被氧化时转移 mol e-。
(2)KBrO3溶液与KBr溶液在酸性条件下反应的离子方程式是 。
(3)滴加KBrO3溶液至过量时观察到溶液褪色,其可能的原因是(用离子方程式表示)
通过该反应 (填“能”或“不能”)说明碘的非金属性强于溴,原因是 。
(4)若用y表示锥形瓶中含碘物质的物质的量 ,用x表示所滴入KBrO3的物质的量,在下图中画出上述整个实验过程中y随x的变化曲线(要求:在图中标出终点坐标)。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是________,写出一种工业制备单质F的离子方程式:__________________________。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为__________,其水溶液与F单质反应的化学方程式为____________________________________________;在产物中加入少量KI,反应后加入CCl4并振荡,有机层显______色。
(3)由这些元素组成的物质,其组成和结构信息如下表:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有非极性共价键的二元离子化合物,且原子数之比为1∶1 |
| c | 化学组成为BDF2 |
| d | 只存在一种类型作用力且可导电的单质晶体 |
a的化学式为________;b的化学式为______________;c的电子式为________;d的晶体类型是________。
(4)由A和B、D元素组成的两种二元化合物形成一类新能源物质。一种化合物分子通过________键构成具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
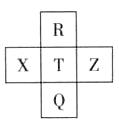 元素R、X、T、Z、Q在元素周期表
元素R、X、T、Z、Q在元素周期表 中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
A.非金属性:Z<T<X
B.R与Q的电子数相差26
C.气态氢化物稳定性:R <T<Q
D.最高价氧化物的水化物的酸性:T>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、R为前四周期元素且原子序数依次增大。X的单质与氢气可以化合生成气体G,其水溶液pH>7;Y单质是一种黄色晶体;R基态原子3d轨道的电子数是4s轨道电子数的3倍。Y、Z分别与钠元素可以形成化合物Q和J ,J的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M。
,J的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M。
请回答下列问题:
⑴M固体的晶体类型是 。
⑵Y基态原子的核外电子排布式是 ① ;G分子中X原子的杂化轨道的类型是 ② 。
⑶L的悬浊液加入Q的溶液,白色沉淀转化为黑色沉淀,其原因是 。
⑷R的一种含氧酸根RO42-具有强氧化性,在其钠盐中加入稀硫酸,溶液变为黄色,并有无色气体产生,该反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
按下列实验方法制备气体,合理而又实用的是( )
A.锌粒与稀硝酸反应制备H2
B.将饱和氨水滴加到新制的生石灰制NH3
C.亚硫酸钠与浓硫酸反应制备SO2
D.大理石与浓硫酸反应制备CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
重水(D2O)是重要的核工业原料,下列说法错误的是( )
A.氘(D)原子核外有1个电子 B.1H与D互称同位素
C.H2O与D2O互称同素异形体 D.1H218O与D216O的相对分子质量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,将0.1 mol·L-1盐酸溶液与0.06 mol·L-1氢氧化钡溶液等体积混合,该混合溶液的pH等于( )
A.1.7 B.2.0 C.12.0 D.12.4
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
| 化学方程式 | 焓变ΔH (kJ·mol-1) | |
| 甲烷 氧化 | CH4(g)+2O2(g)===CO2(g)+2H2O(g) | ΔH1 |
| CH4(g)+O2(g)===CO2(g)+2H2(g) | -322.0 | |
| 蒸汽 重整 | CH4(g)+H2O(g)===CO(g)+3H2(g) | 206.2 |
| CH4(g)+2H2O(g)===CO2(g)+4H2(g) | 165.0 |
①反应CO(g)+H2O(g)===CO2(g)+H2(g)的ΔH=________ kJ·mol-1。
②甲烷的燃烧热为ΔH2,则ΔH2________ΔH1(填“>”、“=”或“<”)。
(2)物质(tBuNO)2在正庚烷溶剂中发生如下反应:
(tBuNO)22(tBuNO) ΔH。
实验测得该反应的ΔH=+50.5 kJ·mol-1,活化能Ea=90.4 kJ·mol-1。下列能量关系图合理的是________________________________________________________________________。
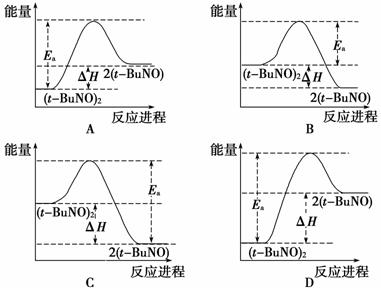
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com