
已知氧化性强弱顺序为BrO3->ClO3->Cl2>IO3->Br2>I2。某同学为验证其中某些离子的氧化性进行如下实验。向盛有30 mL 0.2 mol·L-1 KI溶液的锥形瓶中滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液至过量。
(1)开始滴加KBrO3溶液时的现象为 此时溶液中I-完全被氧化时转移 mol e-。
(2)KBrO3溶液与KBr溶液在酸性条件下反应的离子方程式是 。
(3)滴加KBrO3溶液至过量时观察到溶液褪色,其可能的原因是(用离子方程式表示)
通过该反应 (填“能”或“不能”)说明碘的非金属性强于溴,原因是 。
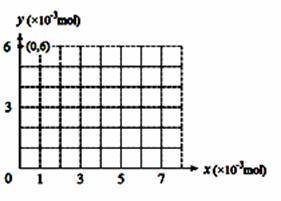
(4)若用y表示锥形瓶中含碘物质的物质的量 ,用x表示所滴入KBrO3的物质的量,在下图中画出上述整个实验过程中y随x的变化曲线(要求:在图中标出终点坐标)。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列各项叙述中,正确的是
A.镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态
B.价电子排布为5s25p1的元素位于第五周期第ⅠA族,是s区元素
C.所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同
D.24Cr原子的电子排布式是:1s22s22p63s23p63d44s2
查看答案和解析>>
科目:高中化学 来源: 题型:
熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极燃气,制得在650 ℃下工作的燃料电池,完成有关的电池反应式:
负极反应式:2CO+2 -4e-====4CO2
-4e-====4CO2
正极反应式_______________________________________________________________;
总电池反应________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
向50 g浓度为c mol·L-1,密度为ρg·cm-3的氨水中加入一定量的水,将其稀释至0.5c mol·L-1,则加入水的体积 ( )
A.小于50 mL B.等于50 mL C.大于50 mL D.等于50/ρ mL
查看答案和解析>>
科目:高中化学 来源: 题型:
在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是
A.sp,范德华力 B.sp2,范德华力
C.sp2,氢键 D.sp3,氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
化学键使得一百多种元素组成了世界万物。有关化学键的下列叙述中,正确的是
A.离子化合物一定不含共价键,共价化合物中不含离子键
B.共价化合物可能含离子键,离子化合物中只含离子键
C.构成单质分子的粒子一定含有共价键
D.在氧化钠中,除氧离子和钠离子的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为________。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是________(填序号)。
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液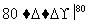 NaClO3溶液
NaClO3溶液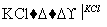 KClO3晶体①完成Ⅰ中反应的总化学方程式:
KClO3晶体①完成Ⅰ中反应的总化学方程式:
 NaCl+
NaCl+ H2O===
H2O=== NaClO3+
NaClO3+ ________。
________。
②Ⅱ中转化的基本反应类型是________________,该反应过程能析出KClO3晶体而无其他晶体析出的原因是____________________________________。
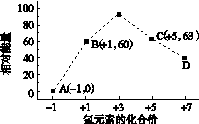
(4)一定条件下,在水溶液中1 mol Cl-、ClO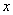 (x=1,2,3,4)的能量(kJ)相对大小如右图所示。
(x=1,2,3,4)的能量(kJ)相对大小如右图所示。
①D是________(填离子符号)。
②B→A+C反应的热化学方程式为________________(用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
用饱和FeCl3溶液制取Fe(OH)3胶体,正确的操作是( )
A.将FeCl3溶液滴入蒸馏水中即可
B.将FeCl3溶液滴入热水中,生成棕黄色液体即可
C.将FeCl3溶液滴入沸水中,并继续煮沸至生成红褐色液体即可
D.将FeCl3溶液滴入沸水中,并继续煮沸至生成红褐色沉淀即可
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com