
向50 g浓度为c mol·L-1,密度为ρg·cm-3的氨水中加入一定量的水,将其稀释至0.5c mol·L-1,则加入水的体积 ( )
A.小于50 mL B.等于50 mL C.大于50 mL D.等于50/ρ mL
 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
下列各微粒:①H3O+、NH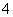 、Na+;②OH-、NH
、Na+;②OH-、NH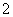 、F-;③O
、F-;③O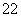 、Na+、Mg2+;④CH4、NH3、H2O具有相同质子数和电子数的一组是
、Na+、Mg2+;④CH4、NH3、H2O具有相同质子数和电子数的一组是
A.①②③ B.①②④
C.②③④ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流,电池总反应:4Al+3O2+6H2O===4Al(OH)3。下列说法不正确的是( )
A、正极反应式:2H2O+O2+4e-===4OH-
B、电池工作时,电流由铝电极沿导线流向铂电极
C、以网状的铂为正极,可增大与氧气的接触面积
D、该电池通常只需要更换铝板就可继续使用
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.构成原电池正极和负极的材料必须是两种金属
B.由Cu、Zn作电极与CuSO4溶液组成的原电池中,Cu是负极
C.马口铁(镀锡铁)破损时与电解质溶液接触,锡先被腐蚀
D.铜锌原电池工作时,若有13 g锌被溶解,电路中就有0.4 mol电子通过
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A、溶液和胶体本质的区别在于胶体能产生丁达尔现象而溶液没有。
B、根据分散剂和分散质的状态(固、液、气)来划分,分散系可分为9种
C、一元中强酸H3PO2的电离方程式为:H3PO2==3H+ + PO23-
D、氧化还原反应本质是元素化合价的升降。
查看答案和解析>>
科目:高中化学 来源: 题型:
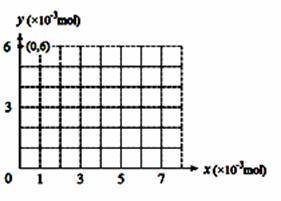
已知氧化性强弱顺序为BrO3->ClO3->Cl2>IO3->Br2>I2。某同学为验证其中某些离子的氧化性进行如下实验。向盛有30 mL 0.2 mol·L-1 KI溶液的锥形瓶中滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液至过量。
(1)开始滴加KBrO3溶液时的现象为 此时溶液中I-完全被氧化时转移 mol e-。
(2)KBrO3溶液与KBr溶液在酸性条件下反应的离子方程式是 。
(3)滴加KBrO3溶液至过量时观察到溶液褪色,其可能的原因是(用离子方程式表示)
通过该反应 (填“能”或“不能”)说明碘的非金属性强于溴,原因是 。
(4)若用y表示锥形瓶中含碘物质的物质的量 ,用x表示所滴入KBrO3的物质的量,在下图中画出上述整个实验过程中y随x的变化曲线(要求:在图中标出终点坐标)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列描述中正确的是
A.CS2为Ⅴ形的极性分子
B.ClO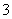 的空间构型为平面三角形
的空间构型为平面三角形
C.SF6中有6对完全相同的成键电子对
D.SiF4和SO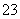 的中心原子均为sp3杂化
的中心原子均为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
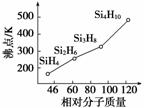
硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是__________________________________________________。
(2)(2012·福建)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示:
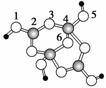
①在Xm-中,硼原子轨道的杂化类型有____________;配位键存在于________原子之间(填原子的数字标号);m=________(填数字)。
②硼砂晶体由Na+、Xm-和H2O构成,它们之间存在的作用力有________(填序号)。
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
(3)(2012·山东节选)金属镍在电池、合金、催化剂等方面应用广泛。
①过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=________。CO与N2结构相似,CO分子内σ键与π键个数之比为________。
②甲醛(H2C===O)在Ni催化作用下加氢可得甲醇(CH3OH)。甲醇分子内C原子的杂化方式为________________________________________________________________________,
甲醇分子内的O—C—H键角________(填“大于”“等于”或“小于”)甲醛分子内的O—C—H键角。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、R为前四周期元素且原子序数依次增大。X的单质与氢气可以化合生成气体G,其水溶液pH>7;Y单质是一种黄色晶体;R基态原子3d轨道的电子数是4s轨道电子数的3倍。Y、Z分别与钠元素可以形成化合物Q和J ,J的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M。
,J的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L;Z与氢元素形成的化合物与G反应生成M。
请回答下列问题:
⑴M固体的晶体类型是 。
⑵Y基态原子的核外电子排布式是 ① ;G分子中X原子的杂化轨道的类型是 ② 。
⑶L的悬浊液加入Q的溶液,白色沉淀转化为黑色沉淀,其原因是 。
⑷R的一种含氧酸根RO42-具有强氧化性,在其钠盐中加入稀硫酸,溶液变为黄色,并有无色气体产生,该反应的离子方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com