
【题目】硫酸铵是一种常见的化肥,某工厂用石膏、NH3、H2O、CO2制备硫酸铵的工艺流程如下:
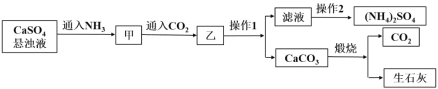
下列说法不正确的是
A. 操作1为过滤,操作2为蒸馏
B. 滤液中的主要阳离子可通过向少量滤液中加NaOH溶液,加热,并用湿润的红色石蕊试纸来检验
C. 甲到乙反应的离子方程式为CaSO4+2NH3+CO2+H2O==CaCO3↓+2NH4++ SO42-
D. 工艺流程中产生的CO2可循环利用
【答案】A
【解析】
流程中,向硫酸钙浊液中通入足量的氨气,使溶液呈碱性,再通入适量的二氧化碳,硫酸钙与氨气、水和二氧化碳反应生成了硫酸铵和碳酸钙沉淀,加热硫酸铵溶液制成饱和溶液,再降温冷却结晶,过滤,得到硫酸铵晶体;碳酸钙煅烧生成氧化钙和二氧化碳,据此分析解答。
A.操作1为过滤,操作2是溶液中得到溶质固体的过程,需要蒸发浓缩、冷却结晶、过滤洗涤干燥等,故A错误;B.滤液中阳离子为铵根离子,向少量滤液中加NaOH溶液,加热,生成能使湿润的红色石蕊试纸变蓝的气体氨气来检验铵根离子,故B正确;C.硫酸钙与氨气、水和二氧化碳反应生成了硫酸铵和碳酸钙沉淀物质发生的主要化学反应为:CaSO4+2NH3+CO2+H2O=CaCO3↓+(NH4)2SO4,反应的离子方程式为:CaSO4+2NH3+CO2+H2O═CaCO3↓+2NH4++SO42-,故C正确;D.反应过程中二氧化碳参与反应生成硫酸铵和碳酸钙,碳酸钙分解生成二氧化碳,工艺流程中产生的CO2可循环利用,故D正确;故选A。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】25℃时,在20ml 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1醋酸溶液,滴定曲线如图所 示,有关粒子浓度的关系中,不正确的是( )

A. 在A点:c(Na+)﹥c(OH-)﹥c(CH3COO-)﹥c(H+)
B. 在B点:c(Na+) ﹦c(CH3COO-) ﹥c(OH-)﹦c(H+)
C. 在C点:c(CH3COO-)﹥c(Na+)﹥c(H+) ﹥c(OH-)
D. 在C点:c(CH3COO-)+c(CH3COOH)﹦2 c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)键线式![]() 表示的分子式____________________;名称是________________________。
表示的分子式____________________;名称是________________________。
(2) 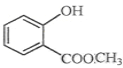 中含有的官能团的名称为_____________________________________。
中含有的官能团的名称为_____________________________________。
(3)丙基的两种结构简式为____________________、______________________。
(4)写出下列有机物的结构简式
2,2,3,3-四甲基戊烷_____________________________
3,4-二甲基-4-乙基庚烷______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某石油化工产品X的转化关系如图,下列判断不正确的是( )

A. X→Y是加成反应
B. 乙酸→W是酯化反应,也是取代反应
C. Y能与Na反应生成氢气
D. W能与氢氧化钠溶液反应,但不与稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1mol某有机物M含碳原子 n mol,在恰好完全燃烧时消耗氧气1.5n mol。请把符合条件的物质类别填入空格。
供选择的物质类别有:烷烃、烯烃、炔烃、二烯烃、环烷烃、芳香烃、饱和一元醇、饱和一元醛、醚、酮。
(1)有机物M可能是(填物质的类别)_____________、_____________、_____________、_____________(你认为有几种填几种,但多填少填要扣分)。
(2)若 4.4克M与足量的金属钠反应可收集到560 ml氢气(标准状况),则有机物M一定是(填物质的类别)____________,且M的摩尔质量为___________________。
(3)具有支链的化合物A的分子式为C4H6O2,A可以使溴的四氯化碳溶液褪色。1molA和1mol NaHCO3能完全反应,则A的结构简式是________________________。
(4)化合物B含有C、H、O三种元素,相对分子质量为60,其中碳的质量分数为60%,氢的质量分数为13.33%。B在Cu的催化作用下被氧气氧化成C,C能发生银镜反应,则C发生银镜反应的化学方程式为__________________________。
(5)D在NaOH水溶液中加热反应,可生成A的钠盐和B,相应反应的化学方程式是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、W四种短周期主族元素,原子序数依次增大,元素性质与原子(或分子)结构如下表所示:
元素编号 | 元素性质与原子(或分子)结构 |
X | 原子核内没有中子 |
Y | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Z | 最内层电子数是最外层的2倍 |
W | 本周期元素中原子半径最小 |
请回答:
(1)写出元素Z在周期表中的位置______,画出元素W的原子结构示意图______。
(2)Y与W相比,气态氢化物稳定性较弱的是________(填化学式,下同),两元素最高价氧化物对应水化物酸性更强的是__________。
(3)X、Y、Z三种元素可以形成化合物ZYX2,可与化合物XW发生反应,生成两种盐,写出该反应的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴乙烷(C2H5Br)的方法为:
NaBr + H2SO4 = NaHSO4 + HBr
C2H5OH + HBr ![]() C2H5Br + H2O
C2H5Br + H2O
其中可能会发生副反应:
2HBr + H2SO4(浓) = Br2 ↑+ SO2↑ + 2H2O
制取的装置和步骤如图(已知溴乙烷的沸点38.4℃,不溶于水):
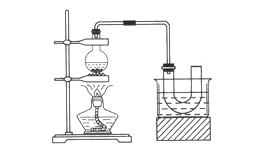
①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在圆底烧瓶中加入10 mL 95%乙醇、28 mL 78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;
③小心加热.使其充分反应.
请根据信息回答下列问题:
(1)反应时若温度过高,可看到有红棕色气体产生,该气体分子式为___________,同时生成的无色气体分子式为________________。
(2)为了更好的控制温度,除用图示的小火加热外,更好的加热方式为________。
(3)反应结束后,U形管内粗制的C2H5Br呈棕黄色。为了除去粗产品中的杂质,可以选择下列试剂中的________________________(填序号)。
A.NaOH溶液 B.H2O C.Na2SO3溶液 D.CCl4
要进一步制得纯净的C2H5Br,可用水洗,然后加入无水CaCl2,再进行__________(填操作名称)。
(4)下列几项实验步骤,为了检验溴乙烷中溴元素,取出少量溴乙烷产品,而后正确的操作顺序是:___________________(填代号)。
①加热;②加入AgNO3溶液;③加入稀HNO3酸化;④加入NaOH水溶液;⑤冷却
A. ④①⑤③② B. ④③①⑤② C. ④③②①⑤ D. ④②①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED系列产品是一类新型节能产品。图甲是NaBH4/H2O2燃料电池,图乙是LED发光二极管的装置示意图。下列叙述错误的是

A.电池A极区的电极反应式为:H2O2+2e-=2OH-
B.电池放电过程中,Na+从负极区向正极区移动
C.每有1mol NaBH4参加反应转移电子数为4NA
D.要使LED发光二极管正常发光,图乙中的导线a应与图甲中的B极相连
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com