
【题目】将少量饱和FeCl3溶液分别滴加到下列物质中,得到三种分散系甲、乙、丙。

(1)将丙继续加热煮沸至液体呈红褐色,反应的化学方程式为____________________________。
(2)如何用最简单的方法判断丙中是否成功制备出胶体?__________。
(3)向经过检验后的丙中逐滴加人盐酸,会出现一系列变化:
①先出现和乙中相同的现象,原因是__________;
②随后发生变化得到和甲相同的溶液,此反应的离子方程式为____________________________。
【答案】FeCl3+3H2O=Fe(OH)3(胶体)+3HCl利用丁达尔效应,用一束光照射所得的液体,从侧面观察是否有—条光亮的“通路”出现Fe(OH)3胶体遇电解质聚沉Fe(OH)3+3H+=Fe3++3H2O
【解析】
(1)实验室制备氢氧化铁胶体的方法是:加热烧杯中的水至沸腾,向沸水滴加几滴饱和氯化铁溶液,继续煮沸至溶液呈红褐色,即停止加热,反应的化学方程式为:FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl,
Fe(OH)3(胶体)+3HCl,
因此,本题正确答案是:FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl;
Fe(OH)3(胶体)+3HCl;
(2)利用丁达尔效应,鉴别胶体和溶液,因此利用丁达尔效应可判断胶体是否制备成功,操作为:用一束光照射所得的液体,从侧面观察是否有—条光亮的“通路”出现;
因此,本题正确答案是:利用丁达尔效应,用一束光照射所得的液体,从侧面观察是否有—条光亮的“通路”出现;
(3)电解质溶液能引起胶体的聚沉,先产生红褐色沉淀,氢氧化铁和盐酸发生反应生成氯化铁和水,随后沉淀溶解,反应的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O;
因此,本题正确答案是:Fe(OH)3胶体遇电解质聚沉;Fe(OH)3+3H+=Fe3++3H2O。


科目:高中化学 来源: 题型:
【题目】已知铜在常温下能被浓HNO3溶解,反应为:
Cu+4HNO3===Cu(NO3)2+2NO2↑十2H2O。
(1)用双线桥法标出电子转移的方向和数目________________________ 。
(2)上述反应中,氧化剂是______,氧化产物是________,还原剂与还原产物的物质的量之比为________。
(3)若有1mol Cu被氧化,则转移电子的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. Fe与稀硫酸反应:2Fe+6H+=Fe3++3H2↑
B. Cu与AgNO3溶液反应:Cu+2Ag+=Cu2++2Ag
C. 向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D. 向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:
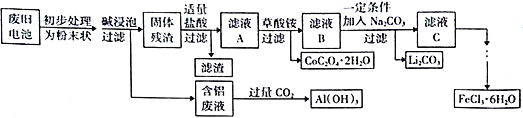
已知:①还原性:Cl->Co2+;
②Fe3+和C2O42-结合生成较稳定的[ Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
(1)废旧电池初步处理为粉末状的目的是________________________________________。
(2)从含铝废液得到Al(OH)3的离子反应方程式为__________________________________。
(3)滤液A中的溶质除HCl、LiCl外还有__________(填化学式)。写出LiCoO2和盐酸反应的化学方程式__________________________________。
(4)滤渣的主要成分为____________________(填化学式)。
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见下表,请补充完整表中问题。
已知:①CoC2O4在空气中加热时的气体产物为CO2
②固体失重率=对应温度下样品失重的质量/样品的初始质量
序号 | 温度范围/℃ | 化学方程式 | 固体失重率 |
Ⅰ | 120-220 | CoC2O4·2H2O | 19.67% |
Ⅱ | 300~350 | _________________________ | 59.02% |
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4,将浓度为0.02mol·L-1的Li2SO4和浓度为0.02 mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为___________mol·L-1
(7)从FeCl3溶液得到FeCl3·6H2O固体的操作关键是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.标准状况下,22.4LH2O所含的分子数为NA
B.14g氮气所含的氮原子数为NA
C.标准状况下,22.4LNH3所含的电子数为NA
D.1molNa与Cl2反应转移电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】呋喃酚是合成农药的重要中间体,其合成路线如下:
(1)A物质核磁共振氢谱共有___个峰,B→C的反应类型是___ .
(2)已知x的分子式为C4H7C1,写出A→B的化学方程式:___ .
(3)Y是X的同分异构体,分子中无支链且不含甲基,则Y的名称(系统命名)是___ .
(4)下列有关化合物C、D的说法正确的是___ .
①可用氯化铁溶液鉴别C和D
②C和D含有的官能团完全相同
③C和D互为同分异构体
④C和D均能使溴水褪色
(5)E的同分异构体很多,写出一种符合下列条件的芳香族同分异构体的结构简式:___ .
①环上的一氯代物只有一种 ②含有酯基 ③能发生银镜反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学一选修5:有机化学基础】某课题组以苯为主要原料,采取以下路线合成利胆药——柳胺酚。
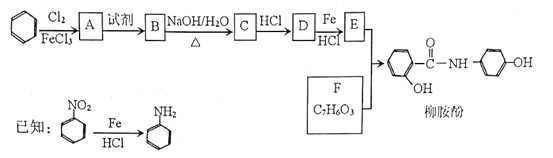
回答下列问题:
(1)F的化学名称____,由E和F生成柳胺酚的反应类型是____。
(2)写出由A生成B反应所需的试剂_____。
(3)写出由B生成C的化学方程式____。
(4)对于柳胺酚,下列说法正确的是____。
a.可发生水解反应 b.不发生硝化反应
c.1 mol柳胺酚最多可以和2molNaOH反应 d.可与溴发生取代反应
(5)写出所有同时符合下列条件的F的同分异构体的结构简式_________。
①苯环上有2种不同化学环境的氢原子;②能发生银镜反应;③能与FeCl3发生显色反应
(6)4-甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )与乙酸制备4-甲氧基乙酰苯胺的合成路线_______________(无机试剂及溶剂任选)。合成路线的书写格式参照如下示例流程图:
)与乙酸制备4-甲氧基乙酰苯胺的合成路线_______________(无机试剂及溶剂任选)。合成路线的书写格式参照如下示例流程图:
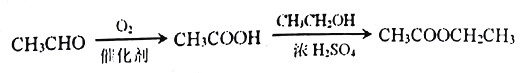
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com