
【题目】钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:
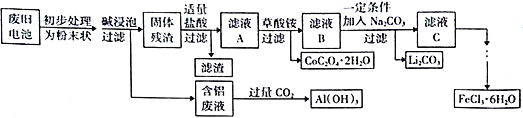
已知:①还原性:Cl->Co2+;
②Fe3+和C2O42-结合生成较稳定的[ Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
(1)废旧电池初步处理为粉末状的目的是________________________________________。
(2)从含铝废液得到Al(OH)3的离子反应方程式为__________________________________。
(3)滤液A中的溶质除HCl、LiCl外还有__________(填化学式)。写出LiCoO2和盐酸反应的化学方程式__________________________________。
(4)滤渣的主要成分为____________________(填化学式)。
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见下表,请补充完整表中问题。
已知:①CoC2O4在空气中加热时的气体产物为CO2
②固体失重率=对应温度下样品失重的质量/样品的初始质量
序号 | 温度范围/℃ | 化学方程式 | 固体失重率 |
Ⅰ | 120-220 | CoC2O4·2H2O | 19.67% |
Ⅱ | 300~350 | _________________________ | 59.02% |
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4,将浓度为0.02mol·L-1的Li2SO4和浓度为0.02 mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为___________mol·L-1
(7)从FeCl3溶液得到FeCl3·6H2O固体的操作关键是_________________________。
【答案】 增大接触面积,加快反应速率,提高浸出率 AlO2-+CO2+2H2O==Al(OH)3↓+HCO3- FeCl3、CoCl2 2LiCoO2+8HCl==2CoCl2+Cl2↑+4H2O+2LiCl C 2CoC2O4+O2![]() 2CaO+ 4CO2 0.02 加入适量盐酸(或通入适量氯化氢气体)
2CaO+ 4CO2 0.02 加入适量盐酸(或通入适量氯化氢气体)
【解析】(1). 废旧电池初步处理为粉末状,可以增大固体的接触面积,加快反应速率,同时提高浸出率,故答案为:增大接触面积,加快反应速率,提高浸出率;
(2). 由流程图可知,含铝废液中含有AlO2-,通入过量CO2生成Al(OH)3沉淀和HCO3-,离子方程式为:AlO2-+CO2+2H2O==Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+2H2O==Al(OH)3↓+HCO3-;
(3). 由题中信息可知,还原性Cl->Co2+,又因为还原性Fe2+>Cl-,所以LiCoO2中的+3价Co将Fe2+和Cl-氧化,自身被还原成+2价Co,所以溶质还有FeCl3、CoCl2,根据上述分析可知,LiCoO2和盐酸反应的化学方程式为:2LiCoO2+8HCl==2CoCl2+Cl2↑+4H2O+2LiCl,故答案为:2LiCoO2+8HCl==2CoCl2+Cl2↑+4H2O+2LiCl;
(4). 因单质碳不溶于碱、盐酸和水,所以滤渣的主要成分是单质碳,故答案为:C;
(5).设有1molCoC2O4·2H2O受热分解,由题中信息可知,在300~350℃时,固体失重率为59.02%,所以固体的残留率为40.98%,质量为75g,因为1molCo全部留在固体中,所以O的质量为16g,Co和O的原子个数比为1:1,固体产物为CoO,已知气体产物为CO2,根据得失电子守恒和原子守恒,该反应的化学方程式为:2CoC2O4+O2![]() 2CaO+ 4CO2,故答案为:2CoC2O4+O2
2CaO+ 4CO2,故答案为:2CoC2O4+O2![]() 2CaO+ 4CO2;
2CaO+ 4CO2;
(6). 将浓度为0.02mol·L-1的Li2SO4和浓度为0.02 mol·L-1的Na2CO3溶液等体积混合,溶液体积变为原来的2倍,Qc=c(Li+)2×c(CO32-)=(0.02mol/L)2×0.01mol/L=4×10-6<Ksp,所以两溶液混合后不产生沉淀,Li+的浓度为0.02mol/L,故答案为:0.02;
(7). 加热蒸发FeCl3溶液得FeCl3·6H2O固体时,会促进Fe3+的水解,最终得到Fe(OH)3固体,因此在加热蒸发FeCl3溶液时,要加入适量的盐酸(或通入适量氯化氢气体)抑制Fe3+的水解,故答案为:加入适量盐酸(或通入适量氯化氢气体)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的氯化钠晶体,但现在只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案: (已知:NH4HCO3![]() NH3↑+H2O+CO2↑)
NH3↑+H2O+CO2↑)
 请回答下列问题:
请回答下列问题:
(1)操作①加热的目的是________________
(2)操作②除用BaCl2溶液外,还可用________。
(3)操作②,判断SO42-已除尽的方法是_____________________________。
(4)操作③的目的是____________,不先过滤后再加Na2CO3溶液的理由是_________。
(5)操作④的名称是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米材料”是粒子直径为几纳米至几十纳米的材料,纳米碳就是其中一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质
①是胶体 ②是溶液 ③能产生丁达尔效应 ④不能透过滤纸 ⑤能透过滤纸 ⑥能透过半透膜
A. ①③⑤ B. ②③④ C. ②③⑤ D. ①③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铁及其化合物的说法不正确的是( )
A.Fe2O3俗称铁红
B.用FeCl3溶液作刻制印刷电路的“腐蚀液”
C.常温下可用铁制容器盛装浓硫酸或浓硝酸
D.水蒸气通过灼热的铁粉生成氢氧化铁和氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。回答下列问题:
(1)0.3mol NH3分子中所含原子数与__________个H2O分子中所含原子数相等。
(2)含0.4mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是__________
(3)—定条件下,16g A和20g B恰好完全反应生成0.04mol C和31.76g D,则C的摩尔质量为__________
(4)某混合盐溶液中含有离子:Na+、Mg2+、Cl-、SO42-,测得Na+、Mg2+和Cl-的物质的量浓度依次为: 0.2mol·L-1、0.25mol·L-1、0.4mol·L-1,则c(SO42-) =__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将少量饱和FeCl3溶液分别滴加到下列物质中,得到三种分散系甲、乙、丙。

(1)将丙继续加热煮沸至液体呈红褐色,反应的化学方程式为____________________________。
(2)如何用最简单的方法判断丙中是否成功制备出胶体?__________。
(3)向经过检验后的丙中逐滴加人盐酸,会出现一系列变化:
①先出现和乙中相同的现象,原因是__________;
②随后发生变化得到和甲相同的溶液,此反应的离子方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用废弃固体(含有Cu2S、Al2O3、Fe2O3、SiO2等)制取粗铜、绿矾(FeSO4·7H2O)和明矾[KAl(SO4)2·12H2O],操作流程如下:

(1)气体a是_________(写化学式,下同),试剂X是_________(已知X是一种盐),固体C是_________。
(2)明矾可以净水,明矾净水的原理是____________________________________(用离子方程式表示)。
(3)利用反应2Cu+O2+2H2SO4![]() 2CuSO4+2H2O可制备CuSO4,若将该反应设计成原电池,该电池的正极反应式为_______________________。
2CuSO4+2H2O可制备CuSO4,若将该反应设计成原电池,该电池的正极反应式为_______________________。
(4)取少量产品绿矾,加水溶解后再滴入几滴KSCN溶液,若产品绿矾中不含有Fe3+,观察到的现象为_________;若在产品绿矾的水溶液中滴加酸性高锰酸钾溶液,观察到的现象为__________________,原因是____________________________ (用离子方程式表示)。
(5)已知绿矾受热分解的化学方程式为2FeSO4·7H2O![]() Fe2O3+SO2↑+SO3↑+14H2O。称取3.5g产品绿矾,加热分解至恒重后(杂质受热不分解),将反应所得的气体缓缓通入盛有足量蒸馏水的锥形瓶中,再用0.1000 mol·L-1的酸性KMnO4溶液滴定,滴定到终点时消耗酸性KMnO4溶液的体积为25.00mL,则产品绿矾的纯度为__________ (保留三位有效数字)。
Fe2O3+SO2↑+SO3↑+14H2O。称取3.5g产品绿矾,加热分解至恒重后(杂质受热不分解),将反应所得的气体缓缓通入盛有足量蒸馏水的锥形瓶中,再用0.1000 mol·L-1的酸性KMnO4溶液滴定,滴定到终点时消耗酸性KMnO4溶液的体积为25.00mL,则产品绿矾的纯度为__________ (保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
H是一种能模拟臭虫信息素以诱捕臭虫的化学物质,可由下列反应路线合成:
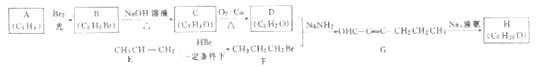
回答下列问题:
(1)A、B、C、D均含有一种相同的官能团,该官能团是__________(写名称),B的结构简式为____________。
(2)由C生成D的化学方程式为_____________________________。
(3)E→F的反应类型是__________,E在通常条件下与HBr反应主要生成F的同分异构体I,I的化学名称是____________。
(4)研究表明,具有反式结构的H才具有诱使臭虫的作用,写出其结构简式:_______________。
(5)C的同分异构体中,不含有C中所有官能团的有_____种,其中能发生银镜反应的是______________(写结构简式,下同),核磁共振氢谱只有1组峰的是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
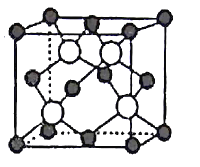
【题目】氮、磷、砷(As)等VA族元素的化合物在研究和生产中有许多重要用途。
(1)写出基态As原子的核外电子排布式___________________。
(2)NH3、PH3、AsH3熔沸点由高到低的顺序为______。
(3)水合肼(N2H4·H2O)又名水合联氨,是一种重要的化工试剂。利用尿素法生产水合肼的原理为:CO(NH2)2+ 2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCL,该反应中所涉及的第二周期元素第一电离能大小顺序是________。晶体N2H4·H2O中各种微粒间的作用力不涉及__(填字母)。
a:离子键 b.共价键 c.金属键 d.氢键 e.范德华力
(4)NO3-的VSEPR模型是____,H3AsO3分子中As的杂化方式为____。
(5)GaAs以第三代半导体著称,性能比硅更优良,广泛用于电子计算机、人造卫星等尖端技术。它的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。GaAs为___ 晶体,晶胞结构与NaCl晶胞____(填“相同”或“不同”)。Ga和As的摩尔质量分别为MGag·mol-l和MAsg·mol-l,原子半径分别为rGapm和rAspm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为___ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com