
【题目】“纳米材料”是粒子直径为几纳米至几十纳米的材料,纳米碳就是其中一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质
①是胶体 ②是溶液 ③能产生丁达尔效应 ④不能透过滤纸 ⑤能透过滤纸 ⑥能透过半透膜
A. ①③⑤ B. ②③④ C. ②③⑤ D. ①③⑤⑥
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列说法正确的是
A. 标准状况下,4.6gNO2和N2O4的混合气体中原子数为0.3NA
B. 1mol 乙烯分子中含有的共价键数为4NA
C. 0.1mol·L-1的硫酸溶液中含H+的数量为0.2NA
D. 氢氧燃料电池中消耗11.2L氢气时转移电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在150℃时碳酸铵可以受热完全分解,(NH4)2CO3 ![]() 2NH3↑ + H2O↑ + CO2↑,则其完全分解后所产生的气态混合物的密度是相同条件下氢气密度的几倍
2NH3↑ + H2O↑ + CO2↑,则其完全分解后所产生的气态混合物的密度是相同条件下氢气密度的几倍
A. 96倍 B. 48倍 C. 12倍 D. 32倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属材料的说法,不正确的是( )
A.不锈钢属于化合物
B.钢是用量最大、用途最广的合金
C.铝制饮料罐应回收利用
D.青铜是铜合金中的一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室以一种工业上的废渣(废渣主要含有MgCO3、MgSiO3和少量Fe、Al的氧化物)为原料,制备MgCO3·3H2O。实验流程如下图所示:

(1)为了加快废渣的酸溶速率,可采取的办法有_________(任写一点),酸溶时废渣中主要成分发生反应的离子方程式为___________________________________。
(2)加入30%H2O2的目的是__________________________________。
(3)用萃取分液的方法除去溶液中的Fe3+
萃取分液完成后,检验水相中是否含有Fe3+的最佳试剂是__________________________。
(4)室温下,除去MgSO4溶液中的A13+(使Al3+浓度小于1×10-6mol/L)而不引入其它杂质,应加入的试剂X为__________,应调节pH的范围为_________________。
已知:①Ksp[Al(OH)3]=1.0×10-33 ②pH=8.5 时,Mg(OH)2开始沉淀
(5)下图为不同反应温度下所得水合碳酸镁的X射线衍射谱图。由图可知,干燥时需控制温度范围为___________________,温度较高时MgCO3·3H2O发生转化的化学方程式为_______________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.纤维素属于髙分子化合物,与淀粉互为同分异构体,水解后均生成葡萄糖
B.某有机物结构如图所示 ,该有机物属于芳香族化合物的同分异构体有5种,其中遇FeCl3能显色的有3种
,该有机物属于芳香族化合物的同分异构体有5种,其中遇FeCl3能显色的有3种
C.含5个碳原子的有机物,每个分子中最多可形成4个C—C单键
D.2,3二甲基丁烷的H—NMR上有5个峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:
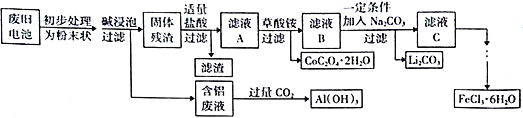
已知:①还原性:Cl->Co2+;
②Fe3+和C2O42-结合生成较稳定的[ Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
(1)废旧电池初步处理为粉末状的目的是________________________________________。
(2)从含铝废液得到Al(OH)3的离子反应方程式为__________________________________。
(3)滤液A中的溶质除HCl、LiCl外还有__________(填化学式)。写出LiCoO2和盐酸反应的化学方程式__________________________________。
(4)滤渣的主要成分为____________________(填化学式)。
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见下表,请补充完整表中问题。
已知:①CoC2O4在空气中加热时的气体产物为CO2
②固体失重率=对应温度下样品失重的质量/样品的初始质量
序号 | 温度范围/℃ | 化学方程式 | 固体失重率 |
Ⅰ | 120-220 | CoC2O4·2H2O | 19.67% |
Ⅱ | 300~350 | _________________________ | 59.02% |
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4,将浓度为0.02mol·L-1的Li2SO4和浓度为0.02 mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为___________mol·L-1
(7)从FeCl3溶液得到FeCl3·6H2O固体的操作关键是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请完成下列物质的分离提纯问题。
Ⅰ.现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,,从而得到纯净的NaNO3溶液。相应的实验过程可用如图表示:

请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X__________,沉淀B________。
(2)证明AgNO3溶液加过量的实验方法是___________。
(3)按此实验方案得到的溶液3中肯定含有_____________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的___________,之后若要获得固体NaNO3需要进行的实验操作是______.(填操作名称)。
Ⅱ.某同学欲用CCl4萃取较高浓度的碘水中的碘,操作过程可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mLCC14加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层。
(1)萃取过程正确操作步骤的顺序是:______(填编号字母)。
(2)最后碘的CCl4是通过获得________(填“漏斗上口”或“漏斗下口”)。从含碘的CCl4溶液中提取碘和回收CCl4,还需要经过蒸馏,观察下图所示实验装置指出其错误有____________处。

(3)进行上述蒸馏操作时,最后晶态碘在_________(填仪器名称)里聚集。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com