
【题目】阿伏加德罗常数的值为NA,下列说法正确的是
A. 标准状况下,4.6gNO2和N2O4的混合气体中原子数为0.3NA
B. 1mol 乙烯分子中含有的共价键数为4NA
C. 0.1mol·L-1的硫酸溶液中含H+的数量为0.2NA
D. 氢氧燃料电池中消耗11.2L氢气时转移电子数为NA
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】已知某工业废水中含有大量FeSO4,较多的Cu2+, 以及部分污泥,通过下列流程可从该废水中回收FeSO4·7H2O晶体及金属Cu。

(1)步骤1的主要操作是___________,(填操作名称)需用到的玻璃仪器除烧杯外还有___________, ___________。
(2)步骤2中发生反应的离子方程式为______________________________
(3)步骤3中发生反应的化学方程式为______________________________
(4)步骤4中涉及的操作是:蒸发浓缩、________、过滤、洗涤、烘干。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】易混易错题组
有机物的命名与结构式结构简式的书写
Ⅰ、官能团能体现有机物的特殊性质,认识下列有机物的官能团。
(1)![]() 的物质类别是_______________
的物质类别是_______________
(2)![]() 中的官能团名称是_______________
中的官能团名称是_______________
(3) 非诺洛芬 中的官能团的结构简式是__________
中的官能团的结构简式是__________
Ⅱ、给下列有机物命名或写出其结构简式:
(1) ______________________________________
______________________________________
(2) _______________________________
_______________________________
(3) ______________________________________
______________________________________
(4)2甲基4乙基庚烷______________________________________________
(5)2,4,6三硝基甲苯___________________________________________
(6)C4H9Cl的核磁共振氢谱表明其只有一种化学环境的氢,则A的化学名称为_________________。
(7)![]() _____________________________
_____________________________
III.写出下列化学方程式
(1)2-丁烯与溴水____________________________________
(2)CaC2→乙炔_____________________________________
(3)苯的溴代________________________________________
(4)2-溴丙烷的消去反应_________________________________
(5)苯乙烯加聚_________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图在盛有溴水的三支试管中分别加入酒精、四氯化碳和苯,振荡后静置,出现下列现象,正确的结论是( )

A. ①加了CCl4 ②加了苯 ③加了酒精
B. ①加了苯 ②加了CCl4 ③加了酒精
C. ①加了酒精 ②加了CCl4 ③加了苯
D. ①加了苯 ②加了酒精 ③加了CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是一种极具发展潜力的清洁能源。
(1)氢气的制取与储存是氢能源利用领域的研究热点.
已知:①CH4的燃烧热为890KJ·mol-1; ②H2的热值为50.2kJ·g-1
则甲烷部分氧化生成CO2和H2的热化学方程式为___________________________________;该反应自发进行的条件是___________。
(2)Bodensteins研究了如下反应:2HI(g)![]() H2(g)+I2(g)△H=+11kJ/mol在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g)+I2(g)△H=+11kJ/mol在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
X(HI) | 1.00 | 0.910 | 0.850 | 0.815 | 0.795 | 0.784 |
X(HI) | 0.00 | 0.600 | 0.730 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:___________。
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,若k正=9.00min-1,在t=20min时,v逆=__________min-1(保留三位有效数字)
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。在上述平衡基础上,缓慢升高到某一温度,反应重新达到平衡,请在下图中画出此过程的趋势图。______________
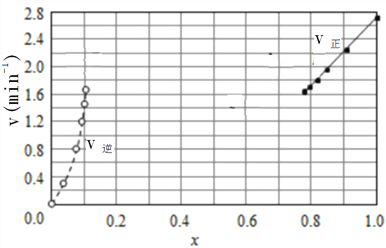
(3)一种可超快充电的新型铝电池,充放电时AlCl4-和Al2Cl7-两种离子在Al电极上相互转化,其它离子不参与电极反应,放电时负极Al的电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性小组为了探究石蜡油分解产物,设计了如下实验方案。下列说法错误的是
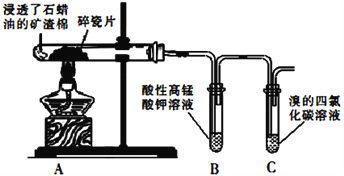
A. 碎瓷片有催化和积蓄热量的作用 B. 试管B、C中溶液均褪色,反应类型不相同
C. 石蜡油与煤焦油的组成相同 D. 结束反应时,先撤出导管,再停止加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积相同的甲、乙两个容器中,分别充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2![]() 2SO3并达到平衡。若在这一过程中,甲容器保持体积不变,乙容器保持压强不变,则关于甲、乙两容器说法正确的是( )
2SO3并达到平衡。若在这一过程中,甲容器保持体积不变,乙容器保持压强不变,则关于甲、乙两容器说法正确的是( )
A. 达平衡时间甲比乙短
B. 乙容器中再充入等物质的量的SO2和O2,重新达平衡时转化率减小
C. 达平衡时,甲中SO2的浓度比乙中SO2的浓度大
D. 达平衡时,甲的转化率比乙低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的氯化钠晶体,但现在只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案: (已知:NH4HCO3![]() NH3↑+H2O+CO2↑)
NH3↑+H2O+CO2↑)
 请回答下列问题:
请回答下列问题:
(1)操作①加热的目的是________________
(2)操作②除用BaCl2溶液外,还可用________。
(3)操作②,判断SO42-已除尽的方法是_____________________________。
(4)操作③的目的是____________,不先过滤后再加Na2CO3溶液的理由是_________。
(5)操作④的名称是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米材料”是粒子直径为几纳米至几十纳米的材料,纳米碳就是其中一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质
①是胶体 ②是溶液 ③能产生丁达尔效应 ④不能透过滤纸 ⑤能透过滤纸 ⑥能透过半透膜
A. ①③⑤ B. ②③④ C. ②③⑤ D. ①③⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com